
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
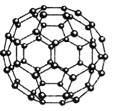
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
【答案】(1)![]() (2)B<C<O<N<F(3)
(2)B<C<O<N<F(3)![]() NH4H+H2O=NH3·H2O+H2↑(4)C60F60
NH4H+H2O=NH3·H2O+H2↑(4)C60F60
【解析】试题分析:元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,原子半径依Y、Z、M、N、Q、X依次减小,X是H元素;六种元素价电子数之和为26,所以Y是B元素、Z是C元素、M是N元素、N是O元素、Q是F元素。
(1)F元素的核外电子排布图为![]() 。
。
(2)同周期元素第一电离能从左到右逐渐增大,由于N元素2P轨道处于半充满状态,第一电离能大于O,所以B、C、N、O、F,第一电离能由小到大的顺序为B<C<O<N<F。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含N元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体,A是NH4H。NH4H的电子式![]() ,常温下NH4H与水反应生成氢气和氨水的化学方程式为NH4H+H2O=NH3·H2O+H2↑。
,常温下NH4H与水反应生成氢气和氨水的化学方程式为NH4H+H2O=NH3·H2O+H2↑。
(4)每个C原子形成4个共价键,60个C原子的共价键总数是4×60÷2=120; C60分子有32个面,其中12个面为正五边形,20个面为正六形,边数=(12×5+20×6) ÷2=90,C60分子共有120-90=30个双键。1个C60分子可与30个F 2分子发生加成反应,则加成产物的化学式为C60F60。


科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
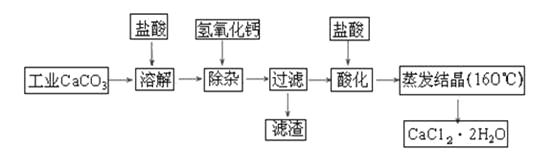
(1)除杂操作时加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①___________________________;②___________________________;
(3)测定样品中Cl-含量的方法是:
A.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;B.量取25.00 mL待测溶液于锥形瓶中;C.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中不需要用盛装溶液润洗的仪器有 ,若润洗后会导致结果
②计算上述样品中CaCl2·2H2O的质量分数为________________;
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(4)工业上冶炼金属钙的方法是 ;请写出此冶炼的化学反应方程式________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有聚集诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的合成路线(部分试剂和反应条件省略):
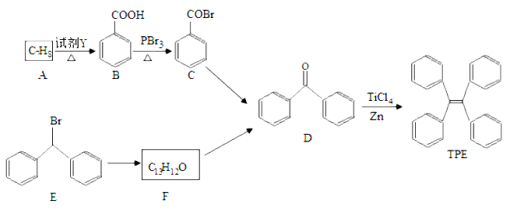
(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型是 ;B中官能团的名称是 ; D中官能团的名称 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:属于萘(![]() )的一元取代物;存在羟甲基(—
)的一元取代物;存在羟甲基(—
CH2OH)。写出W所有可能的结构简式: 。
(5)下列说法正确的是 ( )
a.B的酸性比碳酸强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。
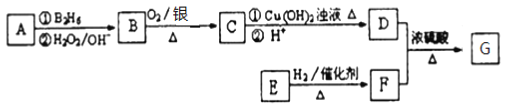
已知:(1) ![]()
(2) 有机物A属于烃类,其相对分子质量为56,核磁共振氢谱有2组峰
(3) E能发生银镜反应,1molE与2molH2可以发生反应生成F
(4)有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下面的问题:
(1)有机物B:____________,反应E→F的反应类型为:____________;
(2)E的结构简式为____________:
(3)A在一定条件下生成高分子化合物的化学方程式为____________;
(4)D+F→G 的化学方程式:____________;
(5)已知有机化合物甲符合下列条件:①芳香族化合物②与F互为同分异构体③能被催化氧化成醛。符合上述条件的有机物甲有____________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰的有机物的结构简式为(写出符合条件的其中一种即可)____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:
![]()
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
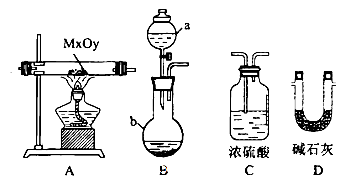
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________ (用含X、y、m、n的式子表示)。
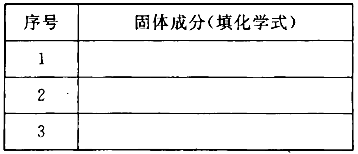
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下: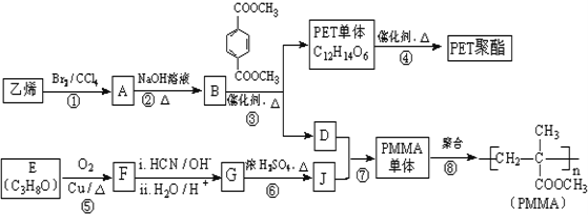
已知:
Ⅰ.RCOOR′+R″18OH ![]() RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ.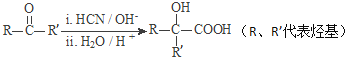
(1)①的反应类型是_____________.
(2)②的化学方程式为_____________.
(3)PMMA单体的官能团名称是_____________、_____________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_____________。
(5)G的结构简式为_____________。
(6)下列说法正确的是_____________(填字母序号).
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1mol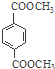 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH
(7)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n或C10n+2H8n+6O4n+2)并生成B的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2丁烯(CH3—CH = CH—CH3)是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2丁烯与氢气反应生成正丁烷,正丁烷的结构简式为 ,正丁烷的同分异构体的系统命名为_____________。
(2)写出2丁烯与溴的四氯化碳溶液反应的化学方程式:_______________,
写出在一定条件下合成聚2丁烯的化学方程式 。
(3)2-丁烯存在着顺、反异构现象,写出反-2-丁烯的结构简式 。
(4)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,烯烃A分子中共平面的原子最多有________个。
(5)研究表明烯烃可发生复分解反应。烯烃的复分解反应指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如两分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。写出在催化剂作用下,(4)中的两个烯烃A分子发生复分解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
A. B电极为正极
B. 气体乙可能为CO2
C. O2在A电极得电子
D. 电池工作时,B电极附近的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu(NH3)4]SO4·H2O。
(1)Cu基态核外电子排布式为 。
[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中碳原子轨道杂化类型为 。
与H2O互为等电子体的一种阴离子为 (填化学式)。
(3)[Cu(NH3)4]SO4·H2O含有 。(填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.氢键
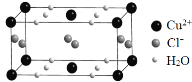
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com