
分析 (1)HB-在水溶液中存在电离平衡和水解平衡两种,电离时显酸性,水解时显碱性;
(2)A.根据水的离子积与温度的关系判断;
B.根据盐类的水解判断;
C.根据溶液中氢氧根离子的来源判断C;
D.根据盐类的水解判断;
(3)根据电离方程式书写,固体不能写入平衡常数表达式;
A.根据溶度积与温度的关系判断;
B.根据QC与KSP的关系判断;
C.根据外界条件对溶度积的影响判断;
D.根据KSP与FeB溶解度的关系判断;
(4)Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,该溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断离子浓度大小;
(5)若0.1mol•L-1的H2B溶液中,一级电离:H2B?H++HB-,二级电离:HB-?H++B2-,根据Ka1=$\frac{c(H{B}^{-})•c({H}^{+})}{c({H}_{2}B)}$计算;Na2B的Kh=$\frac{K{a}_{1}}{{K}_{W}}$.
解答 解:(1)HB-在水溶液中存在电离平衡和水解平衡两种,以电离为主时,溶液显酸性,以水解为主时,溶液显碱性,所以无法确定NaHB溶液的酸碱性,
故答案为:无法确定;
(2)A.水的离子积常数与温度有关,与溶液的酸碱性、浓度无关,所以A可能正确,故A不选;
B.此溶液是强碱弱酸盐,水解溶液呈碱性,pH值可能>7,所以B可能正确,故B不选;
C.电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(B2-)+c(HB-),物料守恒得c(Na+)=c(H2B)+c(B2-)+2c(HB-),所以得c(H+)+c(H2B)=c(OH-)+c(B2-),即C(OH-)=C(H2B)+C(H+)-c(B2-),故C选;
D.由于弱离子的水解,所以C(HB-)<0.1mol/L,故D选;
故答案为:CD;
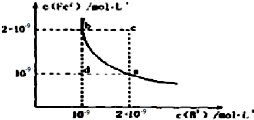
(3)某温度下,FeB(s)?Fe2+(aq)+B2-(aq)的平衡常数表达式为K=c(Fe2+)•c(B2-);
A.在沉淀溶解平衡曲线上的点表示的Ksp相等,点对应的KSP等于b点对应的KSP,故A正确;
B.在d点,还未达到FeB的Ksp,则不会生成沉淀,故B正确;
C.Ksp受温度影响,升温时,Ksp会发生变化,则通过升温不可能由c点变到a点,故C错误;
D.此温度下,KSP=c(Fe 2+ )•c(B 2- )=2×10-9×10-9=2×10-18,故D错误;
故答案为:CD;
(4)A.Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,硫离子两步水解和水电离都生成氢氧根离子,硫离子第一步水解生成硫氢根离子,所以该溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-),故A正确;
B.该物质溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B正确;
C.根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故C正确;
D.根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故D错误;
故答案为:ABC;
(5)若0.1mol•L-1的H2B溶液中,一级电离:H2B?H++HB-,二级电离:HB-?H++B2-,Ka1=$\frac{c(H{B}^{-})•c({H}^{+})}{c({H}_{2}B)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5;Na2B的Kh=$\frac{K{a}_{1}}{{K}_{W}}$=$\frac{1{0}^{-5}}{1{0}^{-14}}$=10-9;
故答案为:10-5;10-9.
点评 本题考查的是弱电解质的电离平衡及难溶电解质的溶解平衡,题目难度中等,考查学生分析图象及结合图象分析问题、解决问题的能力,能正确分析图象是解决(3)题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
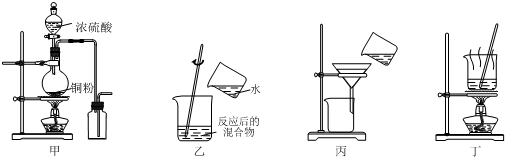
| A. | 用图甲装置制取并收集二氧化硫 | |
| B. | 用图乙装置向反应后的混合物中加水稀释 | |
| C. | 用图丙装置过滤出稀释后混合物中的不溶物 | |
| D. | 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由强至弱的顺序是X>Y>Z | |
| C. | 原子半径大小顺序是X>Y>Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成生成1mol H2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
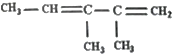 的系统命名是2,3-二甲基-1,3-戊二烯;
的系统命名是2,3-二甲基-1,3-戊二烯;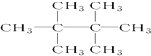 ,名称是2,2,3,3-四甲基丁烷;
,名称是2,2,3,3-四甲基丁烷; ;
; 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有①②③ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com