
分析 A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)A2B2为H2O2,为共价化合物;
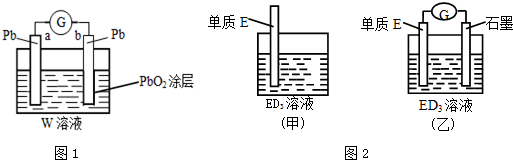
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池.
解答 解:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素.
(1)A2B2为H2O2,为共价化合物,电子式为 ,结构式为:H-O-O-H,故答案为:H-O-O-H;
,结构式为:H-O-O-H,故答案为:H-O-O-H;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,
已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)=$\frac{1000mL×1.3g/mL×39%}{98g/mol}$=5.17mol,
所以剩余的n(H2SO4)=5.07mol,
则浓度为5.07mol/L,故答案为:Pb-2e-+SO42-=PbSO4;5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,氧化反应和还原反应分别在不同极上发生.
故答案为:Fe-2e-=Fe2+.
点评 本题考查元素推断和电化学知识,考查较为综合,题目难度中等,注意正确推断元素的种类为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 当达到了该反应的限度时,正、逆反应的速率为零 | |
| B. | 各物质的浓度不再发生变化时,则达到化学反应的限度 | |
| C. | 升高反应的温度,则反应速率减慢 | |
| D. | 使用催化剂,能改变反应限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皮肤上沾有苯酚可以用酒精清洗 | |
| B. | 502胶把手指粘到一起可以用丙酮溶解502胶 | |
| C. | 有机物都是能燃烧的 | |
| D. | 氟氯代烷可用作制冷剂、灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答下列问题:
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O的结构式H-O-H.
H2O的结构式H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑ | |
| B. | 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O | |
| C. | 醋酸与氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 硝酸银溶液与氯化钾溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | BaCl2、HCl、Na2CO3、NaOH | ||
| C. | BaCl2、Na2CO3、HCl、NaOH | D. | Na2CO3、NaOH、BaCl2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com