

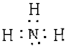 ,故答案为:A中湿润的红色石蕊试纸变蓝;
,故答案为:A中湿润的红色石蕊试纸变蓝;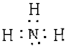 ;
;
| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 将海带灼烧成灰 |
B、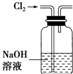 除去Cl2中混有的HCl气体 |
C、 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

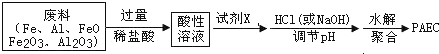
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、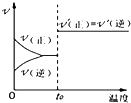 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、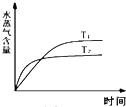 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com