
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯的实验式:C4H6 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 甲醛的结构式: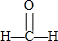 | D. | 聚丙烯的结构简式: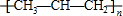 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸 | B. | 通入CO2 | ||
| C. | 加热至固体质量不再减少为止 | D. | 加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸清洗做焰色反应的铂丝 | |
| B. | 金属钠保存在煤油中 | |
| C. | 用丁达尔现象区别溶液与胶体 | |
| D. | 除去粗盐溶液中的Ca2+、SO42-:先加Na2CO3溶液后加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com