
| A、原子半径:W>Y>Z>M>X |
| B、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
| C、W与Z两元素形成的化合物是原子晶体 |
| D、化合物乙中一定只有共价键 |


科目:高中化学 来源: 题型:
| A、铜的质量为12.8g |
| B、硝酸的物质的量浓度为12mol?L-1 |
| C、体现酸性的硝酸为0.8mol |
| D、被还原的硝酸为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体均为无色透明的液体 |
| B、不能跟酸反应的氧化物一定能跟碱反应 |
| C、石油分馏、干冰升华、煤的干馏都只涉及物理变化 |
| D、向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲装置用作原电池时,锌为正极 |
| B、甲装置用作原电池时,银棒上发生:Ag++e-=Ag |
| C、乙装置用作铜片镀镍时,镍作阴极 |
| D、实现铜片表面镀镍时,可将甲中锌棒与乙中铜片相连,甲中银棒与乙中镍片相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| O3 |
| H2O |
| O3 |
| H2O |
| O3 |
| H2O |
| 催化剂 |
 ;则机理b是
;则机理b是
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
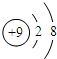 b.
b. c.
c.
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com