
【题目】硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是
A. 陶瓷 B. 金刚石 C. 光导纤维 D. 大理石
科目:高中化学 来源: 题型:
【题目】在某2 L恒容密团容器中充入2 mol X(g)和1mol Y(g)发生反应:2X(g)+ Y(g)![]() 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是

A. Q点时,Y的转化率最大
B. 升高温度,平衡常数增大
C. W点Y的正反应速率等于M点Y的正反应速率
D. 平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a︰b不可能为
A. 3︰4 B. 3︰2 C. 2︰3 D. 4︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的是()
选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
A | 液氯 | 漂白粉 | Al2O3 | CO |
B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
C | 碱石灰 | 盐酸 | K2O | Cl2 |
D | 胆矾 | 水玻璃 | CaO | SO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。

(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因 _________________(用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+![]() O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
H2(g)+![]() O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
CH4(g)+ 2O2 (g)== CO2 (g)+ 2H2O (g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
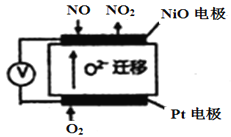
①Pt电极上发生的是 ______________反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=___________________;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4span>(s);②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( )
A.0.1 mol/LB.0.15 mol/LC.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:
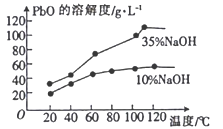
②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,__________,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com