
(14分)亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。
(每空均2分,共14分)(1)NaOH CN-+H2O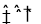 HCN+OH-
HCN+OH-
(2)K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)除去其中的Ca2+
(4)>;(5)3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑
(6)2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-
【解析】
试题分析:(1)NaCN是强碱弱酸盐,在溶液中溶液水解,使溶液显碱性。在实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于NaOH溶液,再用蒸馏水稀释,NaCN水解的离子方程式为
CN-+H2O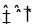 HCN+OH-;(2)实验室K4Fe(CN)6可用于检验Fe3+,检验Fe3+反应的离子方程式为K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)由于在前边加入了CaCl2溶液,在溶液中含有大量的Ca2+会影响制取物质的纯度,为了除去溶液中的Ca2+,要加入碳酸钠溶液一形成CaCO3沉淀除去;(4)在溶液中含有大量的Na+、K+及[Fe(CN)6]-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,说明在相同温度下溶解度:Na4[Fe(CN)6] >K4[Fe(CN)6];(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,根据元素的原子守恒、电子守恒的知识,可得方程式是3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑;(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6], 根据元素的原子守恒及电荷守恒的知识可得:AgCl与黄血盐制取电镀液的离子方程式是2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-。
HCN+OH-;(2)实验室K4Fe(CN)6可用于检验Fe3+,检验Fe3+反应的离子方程式为K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)由于在前边加入了CaCl2溶液,在溶液中含有大量的Ca2+会影响制取物质的纯度,为了除去溶液中的Ca2+,要加入碳酸钠溶液一形成CaCO3沉淀除去;(4)在溶液中含有大量的Na+、K+及[Fe(CN)6]-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,说明在相同温度下溶解度:Na4[Fe(CN)6] >K4[Fe(CN)6];(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,根据元素的原子守恒、电子守恒的知识,可得方程式是3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑;(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6], 根据元素的原子守恒及电荷守恒的知识可得:AgCl与黄血盐制取电镀液的离子方程式是2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-。
考点:考查盐的水解的应用、Fe3+的检验、物质的溶解性的比较、离子方程式的书写的知识。


科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
下列用于解释实验事实的化学方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-= Al(OH)3 
B.纯碱溶液使酚酞变红:CO32-+2H2O ?H2CO3+2OH-
C.乙酸清除水垢后的化学反应原理:2H++CO32-= CO2 + H2O
+ H2O
D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子。
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。
当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列过程中,没有明显实验现象的是
A.少量过氧化钠投入AlCl3溶液 B.向饱和碳酸钠溶液通入CO2气体
C.向Fe(NO3)2溶液中滴加稀硫酸 D.向碳酸氢钠溶液中滴加氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.48g O3气体含有6.02×1023个O3分子
B.5.6g Fe与足量的稀盐酸反应转移电子0.3 mol
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
在反应“X + 酸  化合物 + H2O”中,X不可能是
化合物 + H2O”中,X不可能是
A.FeO B.NaF C.SiO2 D.C2H5OH
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为____________。
(2)由A、B、C三种元素形成的化合物的电子式为________________,这种化合物形成的晶体中所含的化学键类型有________________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为____________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______________________________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为( )(不考虑盐酸的挥发)
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com