
 Al2O3��3H2O
Al2O3��3H2O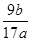 ��100%
��100%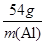 ��
��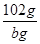 ��m(Al)��
��m(Al)��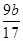 g
g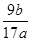 ��100%
��100%


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2K2SO4+2Al2O3 +9SO2 +48H2O�������ж���ȷ����
2K2SO4+2Al2O3 +9SO2 +48H2O�������ж���ȷ����| A���ڱ��������ķ�Ӧ�У���ԭ���������������ʵ���֮����3��4 |
| B�����õ���K2SO4��Һ�����ԣ�����c(K+)=c(SO42-) |
| C�����ղ�����SO2������������,����948 t����(M=" 474" g/mol)����SO2��������Ϊ96%����������������Ϊ98%������432 t |
D����ҵ��ұ��Al2O3�Ƶ�Al����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO(OH)ת��ΪNi(OH)2���õ�ط�Ӧ�Ļ�ѧ����ʽ��Al��3NiO(OH)��NaOH  NaAlO2��3Ni(OH)2 NaAlO2��3Ni(OH)2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ȷ�Ӧ��������õķ��� |
| B���ߴ��ȵĹ赥�������������ά |
| C���������Ⱦ���ǿ���ԣ�����������ˮ��ɱ������ |
| D���������費���κ��ᷴӦ������ʯӢ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��MnO2 | B��WO3 | C��Cr2O3 | D��Co3O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A | B | C | D |
| NaAlO2��Һ����εμ����������� | AlCl3��Һ����εμӰ�ˮ������ | ������Һ����εμ�Ba(OH)2��Һ������ | ����ʯ��ˮ�л���ͨ��CO2������ |
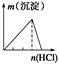 |  | 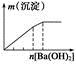 |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
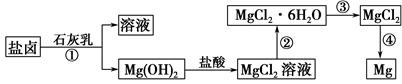
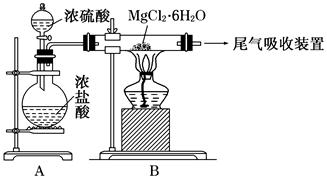
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢۢ� | B���٢ڢ� | C��Z�٢ڢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A������������� | B�������¶� | C�����Ͻ��� | D�����̽���ʱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
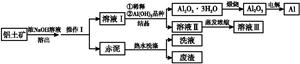
 2NaAlO2(aq)+4H2O,[Al2O3��3H2OҲ�ɱ�ʾΪ2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3��3H2OҲ�ɱ�ʾΪ2Al(OH)3]�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com