
【题目】当人误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒。重金属盐使人中毒的原因是___________________________________。
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO![]() ===H2O+BaSO4↓
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]甲苯是有机化工的一种重要原料,用它制取利尿“呋塞米”和重要的化工中间体“甲基丙烯酸苄基酯”的合成路线如下(部分步骤和条件省略):
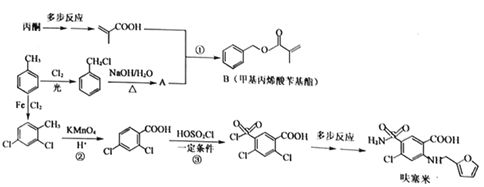
回答下列问题:
(1)A的名称为_________。
(2)反应类型:反应②_________;反应③_________。
(3)反应①的化学方程式_________。
(4)符合下列条件的B的同分异构体(不考虑立体异构)共有_________种。
①某环上只有两个取代基,且每个取代基上碳原子数不超过3个。
②与B具有相同的官能团,1mol该有机物完全水解需要消耗2molNaOH。
写出其中核磁共振氢谱只有5组峰的有机物的结构简式_________。
(5)下列说法正确的是_________。
A.呋塞米既可与强酸反应,又可与强碱反应
B.甲基丙烯酸是丙酸的同系物
C.1mol甲基丙烯酸和丙烯的混合物在氧气中完全燃烧共需要氧气4.5mol
D.可用溴水鉴甲苯和甲基丙烯酸苄基酯
(6)结合以下信息:
① ②RCN
②RCN![]() RCOOH
RCOOH
写出用丙酮和HCN为原料制备化合物![]() 的合成路线__________(其它试剂任选)。
的合成路线__________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.在H2O2分解中加入MnO2
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在NaOH与HCL两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com