
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 ,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: .
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl﹣) 的关系如图1.①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为 . 
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为(任写一个).
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图2
(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)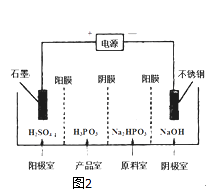
①阳极的电极反应式为: .
②产品室中反应的离子方程式为: .
【答案】
(1)Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=﹣217.4KJ/mol
(2)c(CuCl2)>c(CuCl+)>c(CuCl3﹣);CuCl+═Cu2++Cl﹣
(3)4OH﹣﹣4e﹣=2H2O+O2↑;HPO32﹣+2H+=H3PO3
【解析】 解:(1)①2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 , ②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 , 据盖斯定律(①+②)÷3得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=﹣217.4KJ/mol,所以答案是:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=﹣217.4KJ/mol;(2)①在c(Cl﹣)=9molL﹣1处,做一条平行与纵轴的虚线,可见溶液中主要含铜物种浓度大小关系为:c(CuCl2)>c(CuCl+)>c(CuCl3﹣)>c(Cu2+)>c(CuCl42﹣),所以答案是:c(CuCl2)>c(CuCl+)>c(CuCl3﹣);②从图上可见,在c(Cl﹣)=1molL﹣1的氯化铜溶液中,主要是Cu2+与Cl﹣结合生成CuCl+ , 加入硝酸银,氯离子浓度下降,方程式为:CuCl+═Cu2++Cl﹣ , 所以答案是:CuCl+═Cu2++Cl﹣;(3)①阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;②产品室中HPO32﹣和氢离子结合生成亚磷酸,反应离子方程式为:HPO32﹣+2H+=H3PO3 , 所以答案是:HPO32﹣+2H+=H3PO3 .


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)标准状况下,1.12LCH4的质量为_______g。
(2)与3.2gSO2所含的O原子数相等的NO2的质量为_______g。
(3)配制500mL1.0mol·L-1CuSO4溶液时,在移液洗涤后,摇动容量瓶有少量液体溅出,则所配溶液物质的量浓变会_______(选填“偏高”、“偏低”、“无影响”)。
(4)把2.0mol·L-1Na2SO4溶液和1.0mol·L-1H2SO4溶液等体积混合(假设混合后溶液的体积为两者体积之和),则SO42-的物质的量浓度为_______mol·L-1。
(5)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2。该反应中氧化剂与还原剂的物质的最之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素的存在的操作是( )
A.在卤代烃中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,再加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要含Fe2O3和SiO2)制备绿矾(FeSO4·7H2O),再通过绿矾制备铁矾[FeO(OH)]的流程如下:(已知FeS2和铁矾均难溶于水)
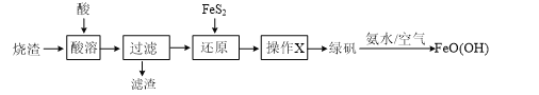
(1)“酸溶”步骤中,最好采用___________________(填“盐酸”、“硫酸”或“硝酸”)溶解烧渣。
(2)写出“还原”步骤发生反应的离子方程式:___________________。
(3)对“还原”后的溶液进行“操作X”,可得到绿矾。“操作X”是指___________________,过滤,洗涤,干燥。
(4)请补充完整检验“还原”后所得溶液中是否含有Fe3+的实验方案:取“还原”后溶液于试管内,___________________。
(5)最后一步制备铁矾的反应中,还生成一种可作化肥的物质,它的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的说法错误的是( )
A. 氧化剂得电子,还原剂失电子
B. 某元素从化合态到游离态,可能被氧化也可能被还原
C. 难失去电子的原子,不一定易得电子
D. 一种元素被氧化,一定有另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
B.标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA
C.常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算
D.0.1 molL﹣1MgCl2溶液中含有的Mg2+数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 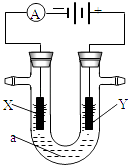
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com