
[选修5——有机化学基础] (15分)
止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:
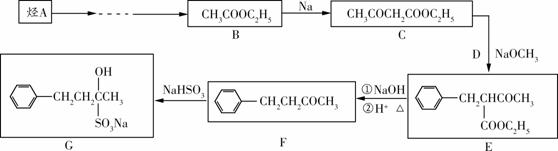
(1)已知烃A可以作为一个国家石油化工生产的标志,则A是________(填结构简式) ;由A合成B发生的化学反应类型有 (填字母)。
a.加成反应 b.酯化反应 c.氧化反应 d.消去反应 e.加聚反应
(2)F中含有的官能团名称为
(3)C的核磁共振氢谱中可能出现 组吸收峰;
(4)已知D为氯代烃,C生成E为取代反应,写出C+D→E的化学方程式 。
(5)1mol F与1mol H2加成后生成有机物M,满足下列条件的M的同分异构体有 种。
① 苯的二元取代物
② 1mol M能与含2mol Br2的浓溴水完全发生反应
写出取代基无支链的一种结构______________
(6)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮的流程图如下。请将虚线处过程补充完整。合成过程中无机试剂任选。

科目:高中化学 来源: 题型:
(2012·上海,十一节选)钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成
0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠钾合金的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
在苯的同系物中,加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是( )
A.苯的同系物分子中,碳原子数比苯多
B.苯环受侧链影响,易被氧化
C.侧链受苯环影响,易被氧化
D.由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇和乙酸
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
查看答案和解析>>
科目:高中化学 来源: 题型:
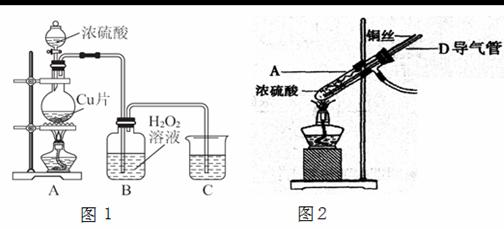 某研究性学习小组设计实验探究铜与浓硫酸的反应。
某研究性学习小组设计实验探究铜与浓硫酸的反应。
(1) 如果用图1装置进行实验:
① 装置A中反应的化学方程式_____________________________________________ 。
② 实验结束后,欲验证反应生成气体的还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是________(填序号)。
A.品红溶液 B.稀盐酸 C.BaCl2溶液 D.稀硝酸
(2)为了更符合绿色化学的要求,该小组有同学建议用图2装置替换图1装置中的A部分进行探究实验。针对图2装置回答:
①改进后的装置符合绿色化学思想的设计是 。
②准备结束实验时立即熄灭酒精灯,B中的液体不会倒吸,其原因是 。
③拆除装置前,不打开胶塞,要使装置中残留气体完全被吸收,应当采取的操作是
。
(3)实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:a ) 氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
b ) 硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
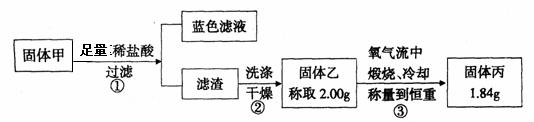
①在煅烧过程中一定发生的反应的化学方程式为 。
②下列对于固体甲成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在 B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S D.固体甲中可能有Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平__________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO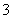 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O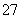 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
________________________________________________________________________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式______________________________________________________
________________________________________________________________________。
(4)已知:①MnO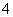 +e-―→MnO
+e-―→MnO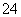 (绿色)(强碱性条件)
(绿色)(强碱性条件)
②MnO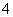 +8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
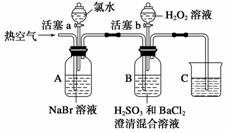
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加 氯水,关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是__ _____________________________________________。
_____________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是__________________
______________________________________________________。
(5)由上述实验得出的结论是________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时,下列说法正确的是 ( )
A.产物n[Cu(NO3)2]∶n[CuSO4]=1∶1
B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既作氧化剂,又作还原剂
D.1 mol Cu2S参加反应时转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的的是 ( )
A.将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2
B.称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/LSnCl2溶液
C.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
D.测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com