
| A. | 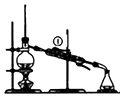 装置A可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. | 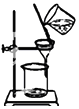 装置B可用于分离汽油和水,且汽油层由分液漏斗的下口放出 | |
| C. | 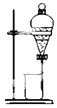 装置C可用于除去固体BaCl2中的BSaO4 | |
| D. | 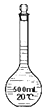 装置D在配制一定物质的量浓度的溶液之前可以有水 |
分析 A.冷凝管通常采用逆向通水,冷凝效果较好;
B.汽油和水为不溶的液态,无法通过过滤操作分离;
C.硫酸钡难溶于水,应该通过过滤操作分离;
D.容量瓶中有少量蒸馏水,不影响配制结果.
解答 解:A.蒸馏操作中,冷凝管应该采用自下而上通水,冷凝效果更好,不能从①通水,故A错误;
B.汽油和水的混合液分层,应该应该分液操作分离,图示装置为过滤,无法达到实验目的,故B错误;
C.除去固体BaCl2中的BaSO4,应该通过过滤操作完成,图示装置为分液,无法达到实验目的,故C错误;
D.配制一定物质的量浓度的溶液时,溶液中有少量水对最终的溶质和溶剂都没有影响,不影响配制结果,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及蒸馏、分液、过滤、溶液配制等知识,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇的燃烧产物对大气无污染,因此它是一种优良的燃料 | |
| B. | 乙醇能与钠反应放出氢气,所以它是电解质 | |
| C. | 0.9%的乙醇可用于杀菌、消毒 | |
| D. | 甲醇和乙醇有相似的气味,均可用于配制饮用酒和调味用的料酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用排饱和食盐水的方法收集氯气 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y>Z | |
| B. | 酸性:W的含氧酸强于Z的含氧酸 | |
| C. | 稳定性:Z的气态氢化物强于Y气态氢化物 | |
| D. | X与Z形成化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
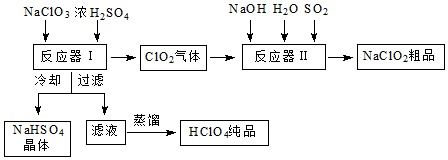
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
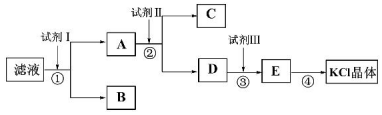
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H2O═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com