

���� ��1�����������ڼ����������ܹ��ֽ��һ���������������ﵽƽ��ʱNO2Ũ��ԼΪ0.0125mol•L-1��˵��Ϊ���淴Ӧ����ƽ��д����ʽ��
��2������v=$\frac{��c}{��t}$����v��NO2��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��O2����
��3��25s���������Ũ�ȼ�����С��45sʱ�ﵽƽ��ʱNO2Ũ��ԼΪ0.0125mol•L-1��
��4�����ڷ�Ӧ��ʼʱ����������������������䣬���̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���ƽ��ʱ��������Ũ�Ȳ��䣮
��� �⣺��1�����������ڼ����������ܹ��ֽ��һ���������������ﵽƽ��ʱNO2Ũ��ԼΪ0.0125mol•L-1��˵��Ϊ���淴Ӧ����Ӧ����ʽΪ��2NO2?2NO+O2��
�ʴ�Ϊ��2NO2?2NO+O2��
��2����ͼ��֪��10����NO2��Ũ�ȱ仯Ϊ0.04mol/L-0.015mol/L=0.025mol/L����v��NO2��=$\frac{0.025mol/L}{10s}$=0.0015mol/��L•s��������2NO2?2NO+O2������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=$\frac{1}{2}$v��NO2��=$\frac{1}{2}$��0.0015mol/��L•s��=7.5��10-4mol/��L•s����
�ʴ�Ϊ��7.5��10-4mol/��L•s����
��3��25s���������Ũ�ȼ�����С���÷�Ӧ���е�45��ʱ���ﵽƽ����NO2Ũ��ԼΪ0.0125mol/L��ʵ����25����70��ķ�Ӧ��������Ϊ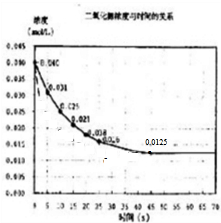 ��
��
�ʴ�Ϊ�� ��
��
��3�����ڷ�Ӧ��ʼʱ����������������������䣩����Ӧ���ʼӿ죬��ͬʱ����NO2Ũ�ȱ仯��������ƽ��ʱ�����̣�����Ӱ��ƽ���ƶ����ﵽƽ����NO2Ũ��ԼΪ0.0125mol/L�����������Ӵ�����ķ�Ӧ��������Ϊ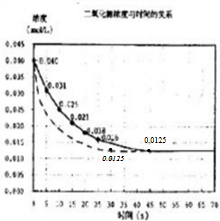 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʵļ���ȣ��Ѷ��еȣ�ע�����֪ʶ���������գ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ں��º��ݵ��ܱ�������ͨ��һ������A��B��������ӦA��g��+2B��g��?3C��g������ͼ��A�ķ�Ӧ����v��A����ʱ��仯��ʾ��ͼ������˵����ȷ���ǣ�������
�ں��º��ݵ��ܱ�������ͨ��һ������A��B��������ӦA��g��+2B��g��?3C��g������ͼ��A�ķ�Ӧ����v��A����ʱ��仯��ʾ��ͼ������˵����ȷ���ǣ�������| A�� | ��Ӧ��A��Ũ�ȣ�a��С��b�� | |
| B�� | �÷�Ӧ��ij����������ܶԷ�Ӧ������� | |
| C�� | �����ϵ�c��d���㶼��ʾ�ﵽƽ��״̬ | |
| D�� | A��ƽ����Ӧ���ʣ�ab�δ���bc�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
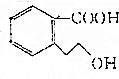 �������й�M��˵����ȷ���ǣ�������
�������й�M��˵����ȷ���ǣ�������| A�� | M�ķ���ʽΪC9H10O3 | |
| B�� | M ��ʹ����KMnO4��Һ��ɫ | |
| C�� | 1 mol M��ȫȼ������10 mol O2 | |
| D�� | 1 mol M��������Na��Ӧ����0.5 mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com