
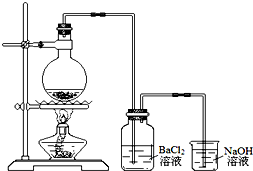
 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)二氧化硫不与二氧化硫反应,但是二氧化硫容易与氢氧化钠溶液反应生成亚硫酸钠,若发生倒吸现象,则亚硫酸钠与钡离子反应生成亚硫酸钡沉淀;
(3)证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,据此设计实验方案;
(4)碱石灰能吸收二氧化硫和水;硫酸酸化高锰酸钾后,影响了二氧化硫的测定;二氧化硫易溶于水,不能使用排水法测量气体体积,据此进行判断;
(5)①稀释浓硫酸时,应该将浓硫酸加入蒸馏水中;
②酚酞的变色范围为8-10,所以滴定终点时溶液的pH=8,则加入的氢氧化钠溶液比剩余溶液中氢离子的物质的量大,测定结果偏大;
(6)根据反应方程式可知,反应消耗的硫酸的物质的量是铜的2倍,据此可以计算出消耗的硫酸的浓度及剩余硫酸的物质的量浓度.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,则铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由于氯化钡不与二氧化硫反应,若生成了白色沉淀,该白色沉淀只能为亚硫酸钡,说明烧杯中的溶液倒吸入广口瓶中,亚硫酸钠与BaCl2溶液反应生成BaSO3沉淀,
故答案为:烧杯中的溶液倒吸入广口瓶中,与BaCl2溶液反应生成BaSO3沉淀;
(3)实验结束后,发现烧瓶中有铜片剩余,由于稀硫酸不与铜反应,则烧瓶中还有较多的硫酸剩余,证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,可以用金属铁或碳酸钠溶液检验,方法为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸,
故答案为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸;
(4)a.将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故a错误;
b.将气体通入硫酸酸化的KMnO4溶液,由于硫酸能够与氯化钡反应生成硫酸钡,干扰了二氧化硫的测定,所以不能用硫酸酸化高锰酸钾溶液,故b错误;
c.二氧化硫易溶于水,测量出的二氧化硫不准确,故c错误;
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故d正确;
故答案为:abc;
(5)①浓硫酸密度大于水,稀释时放出大量热,所以稀释时,应先往烧杯中加入蒸馏水,然后再慢慢加入反应后烧杯中的溶液,
故答案为:烧杯;蒸馏水;
②用酚酞做指示剂,溶液变色时的pH=8>7,则滴定终点时加入的氢氧化钠稍过量,导致测定结果偏大,
故答案为:偏大;
(6)反应的铜的物质的量为:n(Cu)=$\frac{6.4g-3.2g}{64g/mol}$=0.05mol,
根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,反应消耗的硫酸的物质的量是铜的2倍,则反应消耗的硫酸的物质的量为:0.05mol×2=0.1mol,
则反应消耗的硫酸的浓度为:$\frac{0.1mol}{0.01L}$=10mol/L,
所以反应后剩余硫酸的浓度为:18mol/L-10mol/L=8mol/L,
故答案为:8mol/L.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,明确实验目的为解答关键,注意掌握性质实验方案的设计原则及浓硫酸的性质,试题侧重考查学生的分析及化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
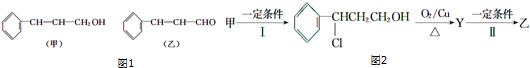
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [Cl-]>[H+]>[NH4+]>[OH-] | C. | [NH4+]>[OH-]>[Cl-]>[H+] | D. | [OH-]>[H+]>[Cl-]>[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
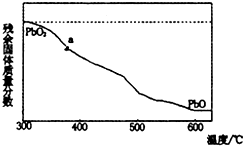 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com