
����Ŀ����1��ʵ��������1000mL0.50mol��L-1��Na2CO3��Һ���ڳ���������Ӧѡ��______mL������ƿ������ʱ��������������̣�1g���������룩�������Ƶ���Һ�����ʵ���Ũ��______0.50mol��L-1������ڡ�����С�ڡ����ڡ�����
��2��������Ϻ��ñ�Na2CO3��Һ�ζ�δ֪Ũ�ȵ�����ʱ��Na2CO3��ҺӦװ��______ʽ�ζ����С�������������Na2CO3��Һ�ζ����ζ�ʱʵ�������б����£�
������� | �������������mL�� | ����Na2CO3��Һ�����mL�� |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
��c(HCl)=______mol��L-1��
��3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ���������������Ũ��______����ԭ����������ȡ��Na2CO3�����л���Na2CO3��10H2O����ʵ�����Ϊ______�����������ƫ�ߡ�����ƫ�͡�����Ӱ�족��
��4����������20 mL 0.1 mol��L��1 Na2CO3��Һ����μ���0.1 mol��L��1 HCl��Һ40 mL����ҺpH���ͣ���ʱ��Һ�к�̼Ԫ�ص��������ʵ���Ũ�ȵİٷֺ���(����)�����ı仯(CO2���ݳ�δ����)��ͼ��ʾ������ͼʾ�ش��������⣺
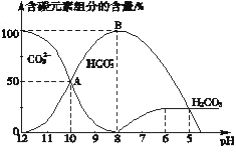
����д��AB�η�Ӧ�����ӷ���ʽ___________________________________
����Ӧ��A��ʱ����Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)_____________________________________________________________________________
���𰸡� 1000 ���� �� 0.85 ƫ�� ƫ�� H+��CO32-��HCO3- c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)
�����������⿼����Һ�������Լ��к͵ζ���������1��ʵ��������1000mL��Һ��Ӧѡ��1000mL������ƿ������n=cV=0.50mol/L��1L=0.50mol����̼���Ƶ�����Ϊ��0.50 mol��106g/mol=53.0g������ʱ������������̣���δʹ�����룬��Ƶõ�̼���Ƶ�����û�����������Ƶ���Һ�����ʵ���Ũ�ȵ���0.50molL��1����2��̼������ǿ�������Σ�ˮ���ʼ��ԣ�Ӧװ�ڼ�ʽ�ζ����У��ɱ����е����ݿ�֪����1��ʵ����������ϴ�Ӧ��ȥ������������̼���Ƶ����ƽ��ֵΪ�� ![]() mL=17.00mL�����ݹ�ϵʽ��2HCl��Na2CO3��n��HCl��=2n��Na2CO3��=2��0.50mol/L��17.00��10��3L��c=
mL=17.00mL�����ݹ�ϵʽ��2HCl��Na2CO3��n��HCl��=2n��Na2CO3��=2��0.50mol/L��17.00��10��3L��c=![]() =
=![]() ����3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ��ʹ̼���Ƶ�Ũ�ȱ�С������̼���Ƶ�������࣬����c�����⣩=
����3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ��ʹ̼���Ƶ�Ũ�ȱ�С������̼���Ƶ�������࣬����c�����⣩=![]() ��֪�����������Ũ��ƫ�ߣ���ԭ����������ȡ��Na2CO3�����л���Na2CO310H2O��ʹ��Һ������̼���Ƶ��������٣�Ũ��ƫ�ͣ��ζ����յ�ʱ�����ĵ�̼���Ƶ����ƫ����������Ũ��ƫ�ߣ���4����OAB��c(HCO3��)Ũ������c(CO32��)Ũ�ȼ�С��˵��CO32����H+��Ӧ����HCO3�������ӷ���ʽΪ��CO32��+H+=HCO3������A��ʱ��c(CO32-)��c(HCO3-)����Һ�е�����Ϊ̼���ơ�̼�����ơ��Ȼ��ƣ���Һ��̼�������ˮ����ڵ����̼������ʼ��ԣ���c(OH��)>c(H+)��Na2CO3����ԭ��Ϊ̼ԭ�ӵ�2��������Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)��c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)��
��֪�����������Ũ��ƫ�ߣ���ԭ����������ȡ��Na2CO3�����л���Na2CO310H2O��ʹ��Һ������̼���Ƶ��������٣�Ũ��ƫ�ͣ��ζ����յ�ʱ�����ĵ�̼���Ƶ����ƫ����������Ũ��ƫ�ߣ���4����OAB��c(HCO3��)Ũ������c(CO32��)Ũ�ȼ�С��˵��CO32����H+��Ӧ����HCO3�������ӷ���ʽΪ��CO32��+H+=HCO3������A��ʱ��c(CO32-)��c(HCO3-)����Һ�е�����Ϊ̼���ơ�̼�����ơ��Ȼ��ƣ���Һ��̼�������ˮ����ڵ����̼������ʼ��ԣ���c(OH��)>c(H+)��Na2CO3����ԭ��Ϊ̼ԭ�ӵ�2��������Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)��c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ���ϰ��������ͻ�ԭ�������̡�������һ����ԭ���̵ķ�Ӧʽ��NO3��+4H++3e����NO+2H2O ��������һ��������ʹ������ԭ���̷����� ��
A.KMnO4B.Na2CO3C.Cu2OD.Fe2(SO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�д�����б仯�����ֱ���ʽ����������ע����Ӧ�Ļ������͡�
������������ȼ��________��
���ڶ������̵Ĵ��¼��������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL18molL��1��ŨH2SO4�м���������CuƬ�����ȣ���ַ�Ӧ����ԭ��H2SO4�����ʵ���Ϊ�� ��
A. ����0.9mol B. ����0.45mol C. ����0.45mol����0.9mol D. ��0.45mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������ȷ����
A. ������������Һ��ȥ�����������Ĥ:Al2O3+2OH-==2A1O2-+ H2O
B. С�մ���������θ�����:CO32-+2H+==CO2��+H2O
C. ��ɫ��AgI����Һ�м���Na2S��Һ���ڣ�2Ag++S2-=Ag2S ��
D. �ö��Ե缫��������Ȼ���:2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ƺ������Ϊԭ���Ʊ��Ȼ�識�����Ʒ�����ƵĹ����������£�
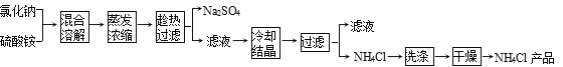
���������ϡ�
������������ʾ������ֻ��NH4Cl�����ֽ⣺NH4Cl![]() NH3��+HCl��
NH3��+HCl��
���Ȼ�狀������Ƶ��ܽ�����¶ȱ仯��������ͼ��ʾ��
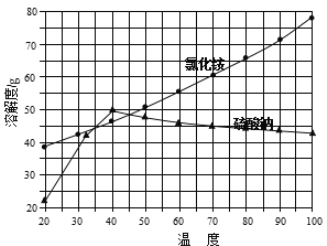
��ش��������⣺
��1��д���Ȼ��ƺ��������Һ��ϵõ������ƾ���Ļ�ѧ����ʽ�� ��
��2�����Ʊ�10.7 g NH4Cl����������NaCl����Ϊ g��
��3��ʵ���ҽ��������ᾧ�õ�����Ҫ����������̨����Ȧ���ƾ����⣬��Ҫ�� ��
��4������ȴ�ᾧ�������У�����NH4Cl����ĺ����¶�Ϊ ��
��5�����������Լ������NH4Cl��Ʒ�Ƿ��ķ�����
�������� | ���� | ���� |
ȡ�����Ȼ�鱗�Ʒ���Թܵײ��� | �����Ȼ�鱗�Ʒ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�С���ش��������⣺
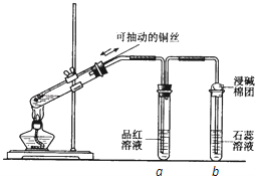
��1��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��________��
��2���Թ�a��b�ֱ����������������ʣ�д���۲쵽�����������á�
�Թ�a�е�������________�� ������________���Թ�b�е�������________��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°�ĸ����Ĵ����������գ��������̿ɼ�Ҫ��ʾ���£�
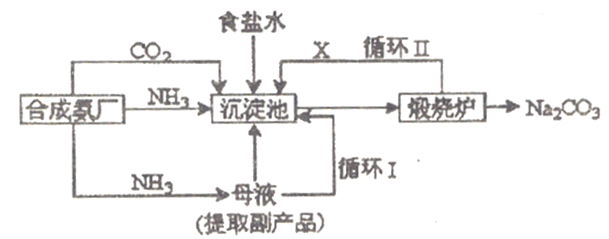
��1������������X���ʵĵ���ʽΪ__________________��
��2���������з����Ļ�ѧ��Ӧ����ʽ��_______________________������¯�з����Ļ�ѧ��Ӧ����ʽ��___________________________��
��3��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����______________________
��4��������д��һ��ʵ������ȡ����̼�����Ƶķ�����(�û�ѧ��Ӧ����ʽ������)_____________________________��
��5��ij̽���С����������Ƽ�ԭ�������Ʊ�̼�����ƣ�ͬѧ�����·�������
ʵ������������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ(ͼ�мг֡��̶��õ�����δ����)��
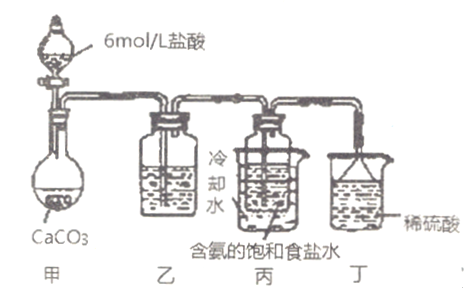
��ش���
�����з�����Ӧ�����ӷ���ʽ��_____________________��
���з�����Ӧ�����ӷ���ʽ��__________________��
����װ���е��Լ���___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8�֣����ࡢ��֬�͵����ʶ�����������Ҫ���л����ʡ�
��1�����������������·���ˮ�ⷴӦ���������ˮ�������������������Լ�Ϊ ��
��2��������ں��������ж������ۺ������飬������Ա��84����Һ�Ե����������������������˵����ʵ����ʣ� ������ţ���A�����ԣ�B��ˮ�⣬C�����ԣ�D��������
��3��ij��֬A�Ľṹ��ʽΪ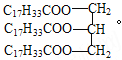 �����������ʿ�����֬A�����������ºͼ�����
�����������ʿ�����֬A�����������ºͼ�����
���¾��ܷ���ˮ�⣬ˮ��Ĺ�ͬ������ ��д�ṹ��ʽ����
��4���۱�ϩ���ơ����ڵĽṹ��ʽ���£�
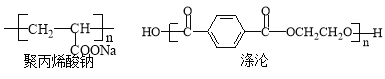
�ϳɾ۱�ϩ���Ƶĵ���Ľṹ��ʽ�� ����Ӧ������ ��
�ϳɵ��������ֵ��壬�����ܺ�NaHCO3��Ӧ�ĵ���Ľṹ��ʽ�� ����˴Ź������ķ�������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com