
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为__,第二周期第一电离能比B高的元素有__种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__(标出配位键),其中心原子的VSEPR模型名称为__,写出[BH4]-的两种等电子体__。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为__(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有__。
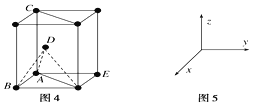
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E、C的坐标分别为B(1,0,0)、E(0,1,0)、C(0,0,1),请写出D点的坐标:D:___。
【答案】![]() 6
6  正四面体形 CH4、NH4+ (BO2)nn- sp3、 sp2 氢键、共价键、范德华力
正四面体形 CH4、NH4+ (BO2)nn- sp3、 sp2 氢键、共价键、范德华力 ![]()
【解析】
(1)B位于周期表中第2周期,第ⅢA族,同周期主族元素,随着原子序数的增大,第一电离能有增大的趋势,但第ⅡA族和第ⅤA族元素反常;
(2)硼化合物是典型的缺电子结构化合物,H3BO3也属于缺电子化合物,可接受OH-的一对孤电子对形成B(OH)4-,根据VSEPR理论说明空间构型,等电子体是指原子数目相同,价电子总数相同的微粒;
(3)根据均摊思想分析偏硼酸根离子的化学式,根据杂化轨道理论判断五硼酸根离子中B原子的杂化方式;
(4)硼酸晶体是片层结构,硼酸分子内存在共价键,分子间存在氢键,分子之间还存在范德华力,晶胞是无隙并置的,不能通过旋转得到,同一层内,存在一组相反的基本结构单元;
(5)根据立体几何知识书写原子坐标。
(1)B是第5号元素,基态B原子的价电子为2s22p1,价电子的轨道表达式为![]() ,第二周期第一电离能比B高的元素有Be、C、N、O、F、Ne等6种。故答案为:
,第二周期第一电离能比B高的元素有Be、C、N、O、F、Ne等6种。故答案为:![]() ,6;
,6;
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的中心原子形成4个σ键,其中有一个是配位键,由O原子提供了孤对电子,其结构式为 ,其中心原子B原子的价层电子对数为4,故其VSEPR模型为正四面体形, [BH4]-的等电子体有CH4、NH4+等。
,其中心原子B原子的价层电子对数为4,故其VSEPR模型为正四面体形, [BH4]-的等电子体有CH4、NH4+等。
(3)由图1可知,偏硼酸根中每个B形成3个共价键、每个O形成2个共价键,所以平均每个B原子结合2个O原子,由B和O的化合价分别为+3和-2可知,其化学式可表示为![]() ;由图2可知,五硼酸根离子中有2种B原子,一种形成4个共价键,另一种形成3个共价键,故其中B原子的杂化方式为sp3、sp2。
;由图2可知,五硼酸根离子中有2种B原子,一种形成4个共价键,另一种形成3个共价键,故其中B原子的杂化方式为sp3、sp2。
(4)硼酸晶体是片层结构的分子晶体,由图3可知,同一层微粒间存在的作用力有氢键、共价键,范德华力等3种;故答案为: 氢键、共价键,范德华力;
(5)若建立如图5所示的坐标系,x与y两轴的夹角为120,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、C的坐标分别为B(1,0,0)、c(0,0,1),由图可知,D点与A、B以及底面右下角等3个点构成一个正四面体,D点位于其顶点,其高度为晶胞高度的一半。由D点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(![]() ,0),所以D点的坐标为D(
,0),所以D点的坐标为D(![]() )。
)。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)可用作还原剂,印染媒染剂、食品防腐剂等。一种湿法制备焦亚酸钠的工艺流程如图。
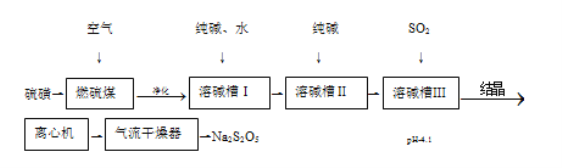
已知:过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺先加热成液态后喷人燃硫炉中,作用是__。
(2)“净化”需要除去的杂质气体是__。
(3)溶碱槽Ⅰ中需要通入足量SO2,若SO2不足,则生成__。
(4)溶碱槽Ⅲ中反应的化学方程式为__。
(5)离心机分离后的母液需要返回到溶碱槽__循环使用(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(6)气流干燥器中发生的化学方程式为__。
(7)为了测定所得产品中Na2S2O5的百分含量,取m克样品加水溶解,用cmol·L-1的碘标准液滴定到终点消耗碘标准液VmL.该产品中Na2S2O5的百分含量为__(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.苯和氯气生成C6H6Cl6的反应是取代反应
B.可以用溴水鉴别苯和四氯化碳溶液
C.等物质的量的甲烷与氯气反应,有机产物只有CH3Cl
D.1mol![]() 最多可与4molH2发生加成
最多可与4molH2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.200g63%的浓硝酸中含氧原子个数为6NA
B.14g乙烯和环丙烷混合物含有的氢原子数目为2NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D. 结构简式为![]() 的一溴代物有5种
的一溴代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
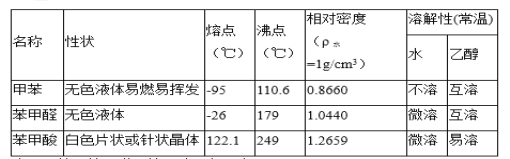
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
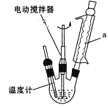
(1)装置a的名称是___,主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__、__(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是___(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.5g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.0mL于锥形瓶,加入0.1mol/LKOH溶液18.0mL恰好反应,产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的三个不同短周期主族元素,无色气体![]() 遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
A.Z单质的沸点低,故Z单质易液化
B.原子半径:![]()
C.最高价氧化物对应水化物的酸性:![]()
D.X、Y、Z与W均能形成既有极性键又有非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
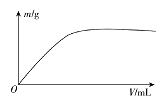
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com