
【题目】焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
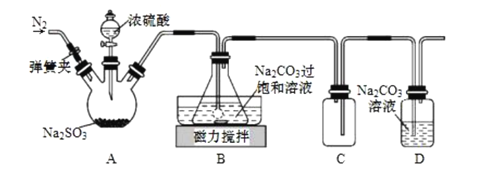
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分解:Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
【答案】90%以上的浓硫酸中氢离子浓度小,反应慢 40℃左右的水浴加热 2SO2+CO32-+H2O=2HSO3-+CO2 吸收充分,防止倒吸 饱和SO2水溶液能减少Na2S2O5在水中的溶解,提高产品收率,无水乙醇可以除去晶体表面水分,且易挥发。 使装置内滞留的SO2全部通入D装置中,被Na2CO3溶液吸收 Kh=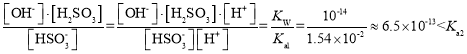 ,HSO3-水解程度小于其电离程度,因此溶液呈酸性
,HSO3-水解程度小于其电离程度,因此溶液呈酸性
【解析】
打开弹簧夹,通入一段时间N2将装置内的其他气体排尽,关闭弹簧夹,A装置中用浓硫酸和亚硫酸钠反应制取二氧化硫,在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,多余的二氧化硫可用氢氧化钠溶液吸收,因二氧化硫易溶于氢氧化钠溶液,C为安全瓶,可防止倒吸。
(1)A装置中利用硫酸和Na2SO3发生复分解反应生成SO2;90%以上的浓硫酸水少,难电离,c(H+)小;
(2)B装置中控制反应温度在40℃左右的方法是水浴加热;向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32+H2O=2HSO3+CO2;
(3)二氧化硫易溶于碱性溶液,C为安全瓶,可防止倒吸;
(4)由反应2NaHSO3===Na2S2O5+H2O可知,增大HSO3-的浓度,有利于生成Na2S2O5,用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,无水乙醇洗涤,可以除去晶体表面水分,且乙醇易挥发;
(5)反应结束后,通入氮气是将滞留的SO2全部赶到装置D中被吸收;
(6)焦亚硫酸钠与水易发生反应:Na2S2O5+H2O===2NaHSO3,溶液中HSO3-既能电离,又能水解,因为水解常数Kh=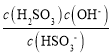 =
=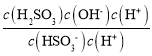 =
=![]() =6.5×10-13<Ka2,所以HSO3-的电离程度大于其水解程度,溶液显酸性。
=6.5×10-13<Ka2,所以HSO3-的电离程度大于其水解程度,溶液显酸性。


科目:高中化学 来源: 题型:
【题目】以物质的量为中心的相关计算,已知阿伏加德罗常数为NA。
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、______个质子。
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为______, M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是_____。
(5)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(6)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途.
Ⅰ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)拟卤素如(CN)2、(SCN)2、(OCN)2 等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足 8 电子稳定结构,则其分子中 σ 键与 π 键数目之比为_______.(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是_____________.
(2)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式_____________.
Ⅱ.SiC、GaN、GaP、GaAs 等是人工合成半导体的材料, 具有高温、高频、大功率和抗辐射的应用性能而成为半导体领域研究热点.试回答下列问题:
(3)碳的基态原子 L 层电子轨道表达式为_______,砷属于_________区元素.
(4)N 与氢元素可形成一种原子个数比为 1:1 的粒子,其式量为 60,经测定该粒子中有一正四面体构型,判断该粒子中存在的化学键_________.
A.配位键 B.极性共价键 C.非极性共价键 D.氢键
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),但 CaC2 晶体中含有的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长. CaC2 晶体中 1 个 Ca2+周围距离最近的 C22﹣数目为________.
Ш. A、B、C 为原子序数依次递增的前四周期的元素,A 的第一电离能介于镁和硫两元素之间,A 单质晶体的晶胞结构如图2 所示. B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的 ds 区,其基态原子不存在不成对电子. B与 C所形成化合物晶体的晶胞如图3 所示.
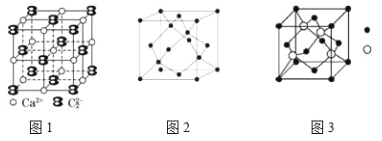
(6)A 单质晶体属于_________晶体(填晶体类型).
(7)B 与 C 所形成化合物晶体的化学式___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示。p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。已知硫酸钡在水中溶解吸收热量。下列说法正确的是( )
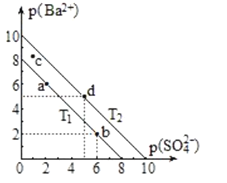
A.温度高低:T1<T2
B.加入BaCl2固体,可使溶液由a点变到b点
C.c点对应的溶液在T1温度时有固体析出
D.T2温度下,BaSO4的Ksp=1×10-25mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
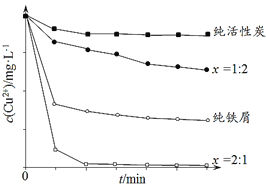
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
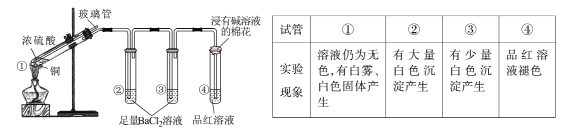
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A.0.1molKHSO4晶体中含有H+数为0.1NA
B.标准状况下,5.6LSO3分子中含有的电子总数为10NA
C.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为3NA
D.33.6gFe与足量的水蒸气加热充分反应,转移电子数为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )

A.Si原子杂化类型为sp3
B.Si、O的原子个数比为1:4
C.Si原子数目与Si—O键数目比为1:4
D.SiO2晶体中最小环为12元环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com