
����Ŀ����ҵ����ȡ����ʯ��Na3AlF6���Ļ�ѧ����ʽ���£�![]()
���������գ�
��1����Ӧ������Ԫ�ض�Ӧ�ļ����Ӻ�������Ų���ͬ���밴���Ӱ뾶�Ӵ�С��˳����������������____������ԭ����������Ԫ��ԭ�Ӻ�����___��������ͬ�ĵ��ӣ����������ӵĵ�������____�ֲ�ͬ����չ����
��2����Ӧ��������Ԫ����Ԫ�����ڱ���λ�����ڣ��ܱȽ����ǵĽ����Ի�ǽ�����ǿ������ʵ��____��ѡ���ţ���
a. ��̬�⻯����ȶ��� b. ����������Ӧˮ���������
c. ������������Ӧ������ d. ������ͬŨ���ᷢ����Ӧ�Ŀ���
��Ӧ�����ֽ���Ԫ�أ����ǵ�����������Ӧ��ˮ����֮�䷢����Ӧ�����ӷ���ʽΪ_______��
��3������ʯ�ڹ�ҵ�Ͽ�����������������ܼ����˷�Ӧ������0.6mol����ת�ƣ�����____���ɵý�����������Ϊ_____�ˡ�
��4����ҵ�ϲ����õ���Ȼ����ķ������Dz��õ���������ķ�����������ʵ�ԭ����______��
���𰸡�O2-��F-��Na+��Al3+ 5 2 ac Al(OH)3+OH-=AlO2-+2H2O �� 5.4 �Ȼ���Ϊ���Ӿ��壬������״̬�²��ܷ�������
��������
��1�����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС��ԭ����������ΪAl����ͬ�ܼ��еĵ���������ͬ�������Ϊ3s23p1����2�ֵ����ƣ�
��2����Ӧ������Ԫ����Ԫ�����ڱ���λ�����ڣ�ΪOԪ�����Ԫ�أ����Ը����⻯���ȶ��ԡ�������������Ӧ���׳̶ȱȽϣ�O��FԪ��û�к����ᣬ����������������Ӧˮ��������ԣ��������ᷴӦ�������ܱȽϷǽ�����ǿ����
��3����������������������Ӧ����ƫ��������ˮ��
��4��������������������Ӧ������������ԭ��Ӧ���������ӷ�����ԭ��Ӧ��Ӧ���������������ݵ���ת���غ����Al�����ʵ�������������Al��������
��5���Ȼ���Ϊ���ۻ���������в��������ӣ�����ʱ���ܵ��硣
(1)O2��F��Na+��Al3+���Ӳ�ṹ��ͬ,�˵����Խ�����Ӱ뾶ԽС,�����Ӱ뾶��O2>F>Na+>Al3+;ԭ����������ΪAl,��������Ų�Ϊ1s22s22p63s23p1,��ͬ�ܼ��еĵ���������ͬ,������5�ֲ�ͬ�����ĵ���;�����Ϊ3s23p1,��2�ֵ�����,�ʴ�Ϊ��O2>F>Na+>Al3+��5��2��
(2)��Ӧ������Ԫ����Ԫ�����ڱ���λ�����ڣ�ΪOԪ�����Ԫ�أ�
a. �⻯��Խ�ȶ����ǽ�����Խǿ��a����ȷ��
b. O��FԪ��û�к����ᣬ����������������Ӧˮ��������ԣ�b�����
c.������������ӦԽ���ף���ӦԪ�صķǽ�����Խǿ��c����ȷ��
d.������ͬŨ���ᷢ����Ӧ�Ŀ��������жϷǽ�����ǿ�����������������Ӧ����S���������ᷴӦ��d�����
��ѡ��ac��
(3)����������������������,�ܺ��������Ʒ�Ӧ,��Ӧ���ӷ���ʽΪ��Al(OH)3+OH=AlO2+2H2O��
�ʴ�Ϊ��Al(OH)3+OH-=AlO2-+2H2O��
(4)������������������Ӧ,����������ԭ��Ӧ,�������ӷ�����ԭ��Ӧ,Ӧ����������;���ݵ���ת���غ�,����Al�����ʵ���Ϊ![]() =0.2mol��������Al������Ϊ0.2mol��27g/mol=5.4g��
=0.2mol��������Al������Ϊ0.2mol��27g/mol=5.4g��
�ʴ�Ϊ������5.4��
(5)��Ϊ�Ȼ���Ϊ���ۻ�������ڷ��Ӿ��壬�����в��������ӣ�����ʱ���ܵ��磬�ʲ��ܱ���⣻��������Ϊ���ӻ��������״̬���Ե��磬
�ʴ�Ϊ���Ȼ���Ϊ���Ӿ��壬������״̬�²��ܷ������롣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ�������
A. CS2 Ϊ�ռ乹��ΪV�εļ��Է���
B. ˫ԭ�ӻ��ԭ���γɵ����嵥���У�һ��������������������
C. ��ԭ�ӵ����Ƶ�һ��С�ڵ��ʾһ������
D. HCN��SiF4��SO32�� ������ԭ�Ӿ�Ϊsp3�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ���һ����̼�ϳɿ�������Դ�״���
(1)��֪����.3CO(g)��6H2(g)![]() CH3CH��CH2(g)��3H2O(g) ��H1����301.3kJ/mol��
CH3CH��CH2(g)��3H2O(g) ��H1����301.3kJ/mol��
��.3CH3OH(g)![]() CH3CH��CH2(g)��3H2O(g) ��H2����31.0kJ/mol��
CH3CH��CH2(g)��3H2O(g) ��H2����31.0kJ/mol��
��CO��H2�ϳ���̬�״����Ȼ�ѧ����ʽΪ___________________________________
(2)ij����С����Cu2O/ZnO�������������£���500��ʱ���о���n(H2)��n(CO)�ֱ�Ϊ2��1��5��2ʱCO��ת���ʱ仯���(��ͼ1��ʾ)����ͼ�б�ʾn(H2)��n(CO)��2��1�ı仯����Ϊ___________(�����a��������b��)��ԭ����_______________________________��
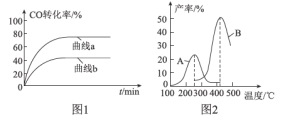
(3)ij����С�����ܱ������г���һ������CO��H2�ϳ���̬�״����ֱ���A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����CH3OH�IJ������¶ȵĹ�ϵ��ͼ2��ʾ������˵����ȷ����____________(��ѡ����ĸ)��
a.ʹ�ô���A�ܼӿ���ػ�ѧ��Ӧ���ʣ�������A��δ���뷴Ӧ
b.�ں��º�ѹ��ƽ����ϵ�г��������CH3OH�IJ��ʽ���
c.��2v(CO)����v(H2)��ʱ����Ӧ�ﵽƽ��״̬
(4)һ���¶��£����ݻ���Ϊ2L�����������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣

��������ƽ��������ѹǿΪ��ʼʱ��![]() ������¶��£��÷�Ӧ��ƽ�ⳣ��K��______��Ҫʹƽ��������������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У�����������c��ȡֵ��ΧΪ_____________________________________��
������¶��£��÷�Ӧ��ƽ�ⳣ��K��______��Ҫʹƽ��������������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У�����������c��ȡֵ��ΧΪ_____________________________________��
(5)CO���ճ�����������ء�
�ټ������β����CO����������CO�����ǣ�����ԭ��������ȼ�ϵ�أ����е������������(Y2O3)�������(ZrO2)���壬�ܴ���O2�������ĵ缫��ӦʽΪ__________________��
��̼����״�[(CH3O)2CO]����С����һ����ɫ������Ʒ����CO�ϳ�(CH3O)2CO����绯ѧ�ϳ�ԭ��Ϊ4CH3OH��2CO��O2![]() 2(CH3O)2CO��2H2O��װ����ͼ3��ʾ��
2(CH3O)2CO��2H2O��װ����ͼ3��ʾ��
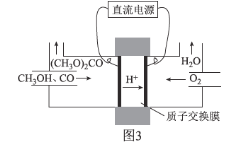
д�������ĵ缫��Ӧʽ��________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L���ܱ������н������·�Ӧ��A(g)+2B(g)![]() 3C(g)+nD(g)����ʼʱAΪ4mol��BΪ6mol��5minĩʱ���C�����ʵ���Ϊ3mol����D��ʾ�Ļ�ѧ��Ӧ����v(D)Ϊ0.2mol/(L��min)������:
3C(g)+nD(g)����ʼʱAΪ4mol��BΪ6mol��5minĩʱ���C�����ʵ���Ϊ3mol����D��ʾ�Ļ�ѧ��Ӧ����v(D)Ϊ0.2mol/(L��min)������:
(1)5minĩA�����ʵ���Ũ��Ϊ________��
(2)ǰ5min����B��ʾ�Ļ�ѧ��Ӧ����v(B)Ϊ________��
(3)��ѧ����ʽ��nֵΪ________��
(4)�˷�Ӧ�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
��v(A)=5mol/(L��min)
��v(B)=6mol/(L��min)
��v(C)=4.5mol/(L��min)
��v(D)=8mol/(L��min)
���з�Ӧ����������________�����ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д��ȷ����
A. ˮ��Һ��NaHCO3���룺NaHCO3 = Na++H++CO32-
B. H2SO3���룺H2SO3![]() 2H++SO32-
2H++SO32-
C. HClO���룺HClO![]() H++ClO-
H++ClO-
D. ˮ��Һ��NaHSO4���룺NaHSO4 = Na++HSO4-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������0.5 mol��L-1��NaOH��Һ500 mL��������������
���ձ���ҩ�ע�1000 mL����ƿ��500 mL����ƿ�ݲ�������������ƽ(������)��
(1)����ʱ������ʹ�õ�������_____(�����)����ȱ�ٵ�������_____����ʵ���������õ��������������÷ֱ���_____��_____��
(2)ʹ������ƿǰ������е�һ��������_____��
(3)����ʱ��һ��ɷ�Ϊ���¼������裺�ٳ��� �ڼ��� ���ܽ� ��ҡ�� ��ת�� ��ϴ�Ӣ߶��� ��װƿ������ȷ�IJ���˳����________��
(4)����һ�����ʵ���Ũ�ȵ���Һ�����Ũ��ƫ�ߵIJ�����_____
A������ʱ���μ�����ˮ�����̶��� B������ʱ���۾����ӿ̶���
C��ϴ���ձ��Ͳ���������Һδת������ƿ�� D������ʱ���۾����ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ������CO��ˮ������Ӧ�Ʊ����������仯����ͼ��ʾ��

(1)�÷�ӦΪ���淴Ӧ����800 ��ʱ����CO����ʼŨ��Ϊ2.0 mol��L-1��ˮ��������ʼŨ��Ϊ3.0 mol��L-1���ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2 mol��L-1����˷�Ӧ��ƽ�ⳣ��Ϊ___�������¶����߸÷�Ӧ�Ļ�ѧƽ�ⳣ���ı仯������___�������������������С��������������
(2)ij�¶��£��÷�Ӧ��ƽ�ⳣ��ΪK=1/9�����¶����ڼס��ҡ������������ܱ�������Ͷ��H2O(g)��CO(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����____(����ĸ)��
��ʼŨ�� | �� | �� | �� |
c(H2O)/mol��L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol��L-1 | 0.010 | 0.010 | 0.020 |
A. ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
B. ƽ��ʱ�����кͱ���H2O��ת���ʾ���25%
C. ƽ��ʱ������c(CO2)�Ǽ��е�2������0.015 mol��L-1
D. ƽ��ʱ������H2O��ת���ʴ���25%
(3)һ�������£����淴ӦN2(g)+3H2(g)![]() 2NH3(g)����H<0���ﵽƽ���
2NH3(g)����H<0���ﵽƽ���
�ټӴ�����v(��)��v(��)�������仯���ұ仯�ı���__(��������������������)��
����С���ʹ��ϵѹǿ������v(��)___��v(��)___(����������������С������������)��v(��)�仯�ı���__v(��)�仯�ı���(��������������С��������������)��
�۽��£�v(��) ____��v(��)__(����������������С������������)��
���º�ѹ����ͨ��һ������He���ﵽ��ƽ��ʱ��N2��ת����__��c(H2)��__(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǻ�ѧ����С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ��ʾ��ͼ�������йظ�װ�õ�˵����ȷ����( )

A. ͭƬΪ�������丽������Һ��������Һ����Cu2������
B. �����пƬ������Ƭ����·�еĵ������ı�
C. ������ת������ʽ��Ҫ������ѧ����������������
D. �����ϡ���ỻ������֭��LED�ƽ����ᷢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�صĵ���X��Y��Z��ͨ��״���¾�Ϊ��̬����������ת����ϵ(��Ӧ������ȥ)��
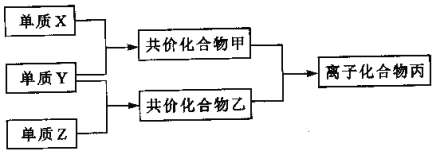
��֪��a. ����˫ԭ�ӵ��ʷ����У�X���Ӻ����۽���ࡣ
b. ���Ӻ�10�����ӣ��ҷ��Ӻ�18�����ӣ��Ҽ��������ɲ����������̡�
(1)X�Ľṹʽ��______________����������ĵ���ʽ___________________��
(2)ʵ���ҿ�����ͼ��ʾװ���Ʊ����ռ��ס�
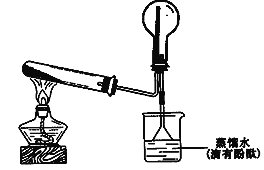
�� д���Թ��з����Ļ�ѧ��Ӧ����ʽ__________________��
�� �ձ�����Һ����ɫ��Ϊ��ɫ����ԭ����(�û�ѧ��Ӧ����ʽ����ʾ)________________��
(3)����Z��ȼ�տ��������ֲ������һ�ֲ��ﶡ�����и�ԭ������㲻ȫ��8���ӽṹ�����Ļ�ѧʽ��____________ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com