
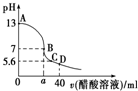
 在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A、溶液酸性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B、C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-) |
| C、在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在D点:c(CH3COOH)=c(CH3COO-)+2c(OH-)-2c(H+) |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
 如图所示,虚线框中每一列、每一行分别对应元素周期表中的一列和一行,但它的列数和行数都多于元素周期表.
如图所示,虚线框中每一列、每一行分别对应元素周期表中的一列和一行,但它的列数和行数都多于元素周期表.查看答案和解析>>
科目:高中化学 来源: 题型:
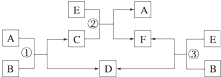 已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:
已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B、无色澄清溶液:CO32-、SO42-、K+、NO3- |
| C、pH=3.8的溶液:NH4+、Na+、NO3-、Fe2+ |
| D、水电离产生的c(H+)=1×10-12 mol?L-1的溶液:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L |
| B、44.8 L |
| C、11.2 L |
| D、4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
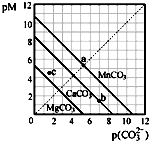 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pc (CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pc (CO32-)=-lg c(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次增大 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示CaCO3 的饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13 | B、14 |
| C、15 | D、不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com