

| 高温 |
| 高温 |
| 1 |
| 2 |
| 19.5g |
| 78g/mol |
| 1 |
| 2 |
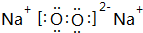 ,故答案为:
,故答案为: ;
;
| ||
| ||


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 |
| B、最外层电子达稳定结构的微粒只能是稀有气体的原子 |
| C、F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子 |
| D、原子核外2p原子轨道上有2个未成对电子的元素一定是氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:
铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Ag++Br-═AgBr↓ | ||||
| B、可用碳酸钠溶液洗涤油污:CO32-+H2O═HCO3-+OH- | ||||
C、用惰性电极电解饱和KCl溶液:2H++2Cl-
| ||||
| D、FeSO4溶液与双氧水、稀硫酸混合:2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com