
将22.4 L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2 B.N2O3 C.N2O D.N2O4
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:
 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: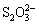 >I-;
>I-;
3I2+6OH-
 +5I-+3H2O;
+5I-+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为: 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为 ,当生成2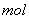 二氧化氯时,转移电子
二氧化氯时,转移电子 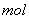 。
。
(4)溶液F在空气中长期放置生成H的化学反应方程式为: 。
(5)H的溶液与稀硫酸反应产生的现象为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )
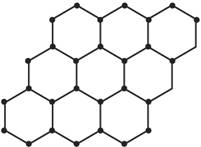
A.石墨烯与石墨互为同位素
B.0.12 g石墨烯中含6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中碳原子间以共价键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
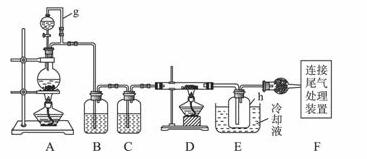
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl下标5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________。
(2)装置A中g管的作用是____________;装置C中的试剂是;装置E中的h瓶需要冷却的理由是____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)如图是离子交换膜法电解饱和食盐水示意图。电解槽阳极产生的气体是____________;NaOH溶液的出口为___________(填字母);精制饱和食盐水的进口为___________(填字 母);干燥塔中应使用的液体是___________。
母);干燥塔中应使用的液体是___________。
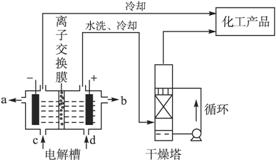
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为____________________________________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为___________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气。现制得氯酸钠213.0 kg,则生成氢气_________m3(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。

①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ______________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
____________________________________________________________________。
反应的离子方程式是____________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。

①温度在T1~T2之间,反应的化学方程式是_________________________。
②温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为: SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):
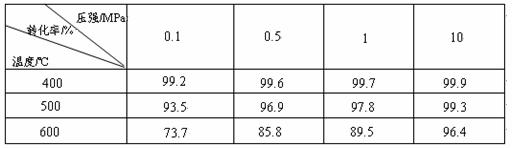
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com