
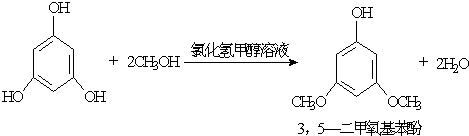
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚, 微溶于水 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 大多数概念间存在如图三种关系:
大多数概念间存在如图三种关系:| 概念I | 概念II | 相互关系 | |
| A | 无机酸 | 离子化合物 | 包含关系 |
| B | 胶体 | 分散系 | 相交关系 |
| C | 非金属氧化物 | 酸性氧化物 | 相离(并列)关系 |
| D | 复分解反应 | 氧化还原反应 | 相离(并列)关系 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
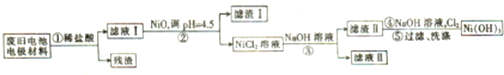
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
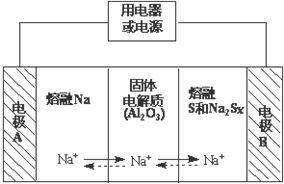 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com