
【题目】中科大研制出Ni-Mo-O纳米棒复合催化剂,利用其进行尿素电解,可实现富尿素废水的净化,同时低能耗制得H2。总反应为:CO(NH2)2 + H2O![]() 3H2↑ + N2↑ + CO2↑。
3H2↑ + N2↑ + CO2↑。
完成下列填空:
(1)上述反应涉及的元素中,质子数最多的原子其核外电子排布式是___________;写出同周期元素的原子半径大小关系____________(用元素符号表示)。
(2)上述反应物与产物中,属于电解质的是_____________(填化学式);写出可以冷冻待移植器官的物质的电子式_______________。
(3)C与N的非金属性强弱顺序为____________(用元素符号表示),用一个化学方程式进行证明________________。
(4)已知常压下,二氧化硅熔点为1723℃,而干冰在-78.5℃时就升华,解释二者性质差异大的原因___________________。
(5)电解富尿素废水时,氢气在____极产生。若转移0.3 mol电子,两极产生的气体共__________L(标准状况)。
【答案】1s22s22p4 C>N>O H2O ![]() N>C HNO3 + NaHCO3 =NaNO3 + H2O + CO2↑ CO2是分子晶体,熔化时需要克服分子间作用力,SiO2是原子晶体,熔化时需要克服的是共价键,所以两者之间的熔沸点差异很大 阴 5.6
N>C HNO3 + NaHCO3 =NaNO3 + H2O + CO2↑ CO2是分子晶体,熔化时需要克服分子间作用力,SiO2是原子晶体,熔化时需要克服的是共价键,所以两者之间的熔沸点差异很大 阴 5.6
【解析】
(1) CO(NH2)2 + H2O![]() 3H2↑ + N2↑ + CO2↑反应涉及的元素中,质子数最多的是O元素,同周期元素有C、N、O,结合原子核外电子的排布规律和元素周期律解答;
3H2↑ + N2↑ + CO2↑反应涉及的元素中,质子数最多的是O元素,同周期元素有C、N、O,结合原子核外电子的排布规律和元素周期律解答;
(2) 根据电解质的概念和物质的用途分析解答;
(3) 同周期元素从左到右,元素的非金属性逐渐增强,比较元素的非金属性,可以利用最高价含氧酸的酸性强弱等依据分析解答;
(4) CO2是分子晶体,SiO2是原子晶体,据此分析解答;
(5)电解富尿素废水制H2,根据总反应为CO(NH2)2+H2O═3H2↑+N2↑+CO2↑,阴极的电极反应:2H2O+2e-=H2↑+2OH-,阳极的电极反应:CO(NH2)2-6e-+6OH-=N2↑+CO2↑+5H2O,据此分析解答。
(1) CO(NH2)2 + H2O![]() 3H2↑ + N2↑ + CO2↑反应涉及的元素中,质子数最多的是O元素,其核外电子排布式为1s22s22p4;反应涉及的元素中,同周期元素有C、N、O,同一周期自左而右,原子半径逐渐减小,原子半径C>N>O,故答案为:1s22s22p4;C>N>O;
3H2↑ + N2↑ + CO2↑反应涉及的元素中,质子数最多的是O元素,其核外电子排布式为1s22s22p4;反应涉及的元素中,同周期元素有C、N、O,同一周期自左而右,原子半径逐渐减小,原子半径C>N>O,故答案为:1s22s22p4;C>N>O;
(2) CO(NH2)2 + H2O![]() 3H2↑ + N2↑ + CO2↑,反应物与产物中,属于电解质的有H2O;液氮可以用作冷冻剂,其电子式为
3H2↑ + N2↑ + CO2↑,反应物与产物中,属于电解质的有H2O;液氮可以用作冷冻剂,其电子式为![]() ,故答案为:H2O;
,故答案为:H2O;![]() ;
;
(3) 同周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,非金属性N>C,比较元素的非金属性,可以利用硝酸与碳酸盐可以反应生成碳酸(二氧化碳和水)证明,如HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑,故答案为:N>C;HNO3 + NaHCO3 =NaNO3 + H2O + CO2↑(其他合理答案均可);
(4) CO2是分子晶体,熔化时需要克服分子间作用力,SiO2是原子晶体,熔化时需要克服的是共价键,所以二氧化硅熔点为1723℃,而干冰在-78.5℃时就升华,两者之间的熔沸点差异很大,故答案为:CO2是分子晶体,熔化时需要克服分子间作用力,SiO2是原子晶体,熔化时需要克服的是共价键,所以两者之间的熔沸点差异很大;
(5)电解富尿素废水制H2,总反应为CO(NH2)2+H2O═3H2↑+N2↑+CO2↑,在阴极上放出氢气,电极反应:2H2O+2e-=H2↑+2OH-,放出氮气的电极为阳极,电极反应:CO(NH2)2-6e-+6OH-=N2↑+CO2↑+5H2O,若转移0.3 mol电子,阴极产生0.15mol氢气,阳极产生0.05mol氮气和0.05mol二氧化碳,两极产生的气体共0.25mol,在标准状况下的体积为0.25mol×22.4L/mol =5.6L,故答案为:阴;5.6。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
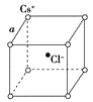
A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验描述、对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq) +3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现 黄色沉淀 | Ksp:AgCl<AgI |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是

A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com