
【题目】锰的化合物是优良的催化剂,并可用于干电池原料生产等。
(1)普通锌锰干电池的反应为:2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2。
①MnO(OH)中锰元素的化合价为_________。电解质的主要成分是_____________________(填化学式);
②与普通锌锰电池相比,碱性锌锰电池_________(填序号)
a.比能量大 b.电流小
c.存储时间长 d.不能连续放电
(2)向普通锌锰废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为________________________(填化学式)。
已知:Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10-25,Ksp(FeS)=6×10-18
(3)合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
a.可加快该反应速率 b.可增大该反应活化能
c.改变该反应平衡常数 d.提高该反应转化率
(4)向盛有4 mL 0.01mol/L KMnO4酸性溶液中滴入2 mL 0.1mol/L H2C2O4(草酸)溶液,开始颜色变化不明显,一段时间后,颜色变化突然加快,颜色很快消失。分析产生此现象的可能原因____________(填序号)。
a.该反应为放热反应,放出的热量加快反应速率
b.溶液呈酸性,H+ 起催化作用
c.K+ 起催化作用
d.反应产生的Mn2+ 起催化作用
(5)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) ΔH1,其反应机理如右图示。已知反应Ⅱ为:MnO2(s)+H2O2(1)+2H+(aq)=Mn2+(aq)+O2(g)+2H2O(1) ΔH2。

写出反应 I的热化学方程式(焓变用ΔH1和ΔH2表示):____________________________________________________________。
【答案】 +3 NH4Cl ac ZnS ![]() a ad H2O2(1)+Mn2+(aq)=2H+( aq)+MnO2(s) ΔH=ΔH1-ΔH2
a ad H2O2(1)+Mn2+(aq)=2H+( aq)+MnO2(s) ΔH=ΔH1-ΔH2
【解析】试题分析:(1)①根据元素化合价代数和等于0计算MnO(OH)中锰元素的化合价;根据电池总反应可知,电解质是氯化铵;②碱性电池,锌粉放在电池内部不易发生电解质的泄露;(2)难溶电解质的Ksp越小,溶解度越小,越易生成沉淀;(3)平衡常数=![]() ;催化剂通过降低活化能,加快反应速率,但催化剂不能使平衡发生移动;(4)根据影响反应速率的因素分析;(5)根据盖斯定律书写反应 I的热化学方程式;
;催化剂通过降低活化能,加快反应速率,但催化剂不能使平衡发生移动;(4)根据影响反应速率的因素分析;(5)根据盖斯定律书写反应 I的热化学方程式;
解析:(1)①根据元素化合价代数和等于0,MnO(OH)中锰元素的化合价为+3;根据电池总反应可知,电解质是氯化铵;②碱性电池,锌粉放在电池内部不易发生电解质的泄露,所以比能量大,故a正确;存储时间长,故c正确;(2)难溶电解质的Ksp越小,溶解度越小,越易生成沉淀,所以最先生成的沉淀是ZnS;(3)平衡常数K =![]() ;催化剂通过降低活化能,加快反应速率,故a正确;催化剂能降低反应活化能,故b错误;催化剂不能使平衡发生移动,平衡常数不变,故c错误; 平衡不移动,该反应平衡转化率不变,故d错误;(4)温度升高可以加快反应速率,该反应为放热反应,放出的热量加快反应速率,故a正确; b.该反应消耗氢离子,氢离子浓度减小,故b错误;c.K+ 浓度不变,故c错误; d.反应生成Mn2+,Mn2+浓度增大,反应速率增大,可能是Mn2+ 起催化作用,故d正确。 ;(5)① 2H2O2(l)=2H2O(l)+O2(g) ΔH1;② MnO2(s)+H2O2(1)+2H+(aq)=Mn2+(aq)+O2(g)+2H2O(1) ΔH2
;催化剂通过降低活化能,加快反应速率,故a正确;催化剂能降低反应活化能,故b错误;催化剂不能使平衡发生移动,平衡常数不变,故c错误; 平衡不移动,该反应平衡转化率不变,故d错误;(4)温度升高可以加快反应速率,该反应为放热反应,放出的热量加快反应速率,故a正确; b.该反应消耗氢离子,氢离子浓度减小,故b错误;c.K+ 浓度不变,故c错误; d.反应生成Mn2+,Mn2+浓度增大,反应速率增大,可能是Mn2+ 起催化作用,故d正确。 ;(5)① 2H2O2(l)=2H2O(l)+O2(g) ΔH1;② MnO2(s)+H2O2(1)+2H+(aq)=Mn2+(aq)+O2(g)+2H2O(1) ΔH2
根据盖斯定律①-②得反应 I的热化学方程式H2O2(1)+Mn2+(aq)=2H+( aq)+MnO2(s) ΔH=ΔH1-ΔH2;


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池,下列判断错误的是
2Fe2++I2设计成如图所示的原电池,下列判断错误的是
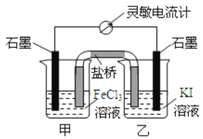
A. 反应开始时,乙中电极反应为2I--2e-=I2
B. 反应开始时,甲中石墨电极上发生还原反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 平衡时乙中溶入碘后,甲池的石墨电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁粉和氧化铜的混合物8.32g,进行如下实验:

根据实验所得数据,有关说法正确的是
A. 无色气体的质量为0.2g
B. 原混合物中铁的质量为7.0g
C. 反应后的溶液中金属离子物质的量为0.1mol
D. 反应消耗的H2SO4物质的量为0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时H2S饱和液浓度为0.1 mol·L-1,电离方程式为H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
A. 加入少量的水 B. 加入少量的NaOH固体
C. 通入少量的SO2 D. 加入少量的CuSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用水稀释0.1 mol/L的醋酸溶液,随加水量的增加而增大的是( )
A.n(CH3COOH) B.c(H+) C. c(H+) ·c(OH-) D. c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com