
【题目】化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
A.SiO2具有导电性,可用于制作光导纤维和光电池
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.乙酰胺(![]() )与甘氨酸的化学性质相同
)与甘氨酸的化学性质相同
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】草酸合铁(III)酸钾晶体[K3[Fe(C2O4)3]·3H2O]是制备负载型活性铁催化剂的主要原料。某科研团队以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]为原料制备草酸合铁(III)酸钾晶体的具体流程如图:
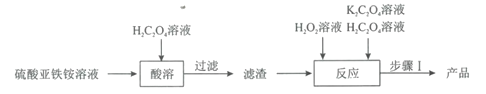
回答下列问题:
(1)配制100mL1.00mol·L-1的硫酸亚铁铵溶液。溶液配制过程中需用到的玻璃仪器除烧杯、玻璃棒、量筒外,还有___。在配制时需加入适量稀硫酸的目的是___。
(2)取12.5mL硫酸亚铁铵溶液于烧杯中,水浴加热至100℃,缓缓滴入饱和H2C2O4溶液,有黄色沉淀(FeC2O4·2H2O)生成,反应的离子方程式为___。
(3)在“酸溶”操作中,需保持溶液的pH为3.5,溶液中![]() =___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
=___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
(4)在“反应”中,先维持40℃水浴加热,滴加10mL6%H2O2溶液,一段时间后,再微沸2min;然后冷却,继续交替滴加H2C2O4和K2C2O4溶液直至溶液呈亮绿色。维持40℃水浴加热使最终所得产品产率最高的原因是__,溶液微沸的目的是__。
(5)经“步骤I”结晶、抽滤、洗涤、避光干燥,最终得到产品5.45g,产品的产率为____(保留1位小数)。
(6)草酸合铁(I)酸钾晶体为光敏配合物,应避光保存,光照时会发生光化学分解反应生成草酸钾和草酸亚铁,同时有气体生成,反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的硫酸亚铁固体,利用下图装置进行实验。
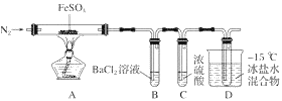
实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是__________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________。
(3)实验④反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
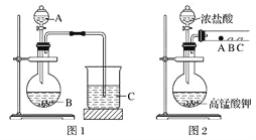
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com