
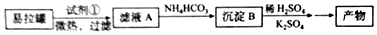
分析 I.Mg在二氧化碳中燃烧生成MgO和C;
II.铝热反应需要引发剂引发高温反应,镁条在空气中可以燃烧,氧气是氧化剂.但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应;
铁能和铁离子反应生成亚铁离子,亚铁离子和KSCN溶液不反应;
III易拉罐中加入试剂a并微热、过滤,得到滤液A,向滤液A中加入碳酸氢铵得到沉淀B,B溶于稀硫酸并加入硫酸钾,经过一系列操作得到明矾,根据明矾成分知,B为Al(OH)3,滤液A中含有铝元素,则试剂①时,Mg、Fe不反应而Al反应,则该试剂为强碱溶液,常用NaOH,A中溶质主要为NaAlO2,
(1)Al和NaOH溶液反应生成偏铝酸钠和氢气;
(2)B是氢氧化铝,明矾中铝离子水解导致溶液呈酸性;
(3)Al(OH)3沉淀溶解在NaOH溶液里发生的反应为Al(OH)3+OH-?AlO2-+2H2O,结合水的离子积和氢氧化铝的电离平衡常数计算此反应的平衡常数.
解答 解:Ⅰ.Mg在二氧化碳中燃烧生成MgO和C,反应方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
Ⅱ.铝热反应需要引发剂引发高温反应,镁条在空气中可以燃烧,氧气是氧化剂.但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应,所以还需要的试剂是氯酸钾和Mg,故选bd;
铁能和铁离子反应生成亚铁离子,亚铁离子和KSCN溶液不反应,所以根据该现象不能确定固态中是否含有氧化铁,涉及的离子方程式分别为Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
故答案为:bd;不能; Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;
III.易拉罐中加入试剂a并微热、过滤,得到滤液A,向滤液A中加入碳酸氢铵得到沉淀B,B溶于稀硫酸并加入硫酸钾,经过一系列操作得到明矾,根据明矾成分知,B为Al(OH)3,滤液A中含有铝元素,则试剂①时,Mg、Fe不反应而Al反应,则该试剂为强碱溶液,常用NaOH,A中溶质主要为NaAlO2,
(1)Al和NaOH溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)B为Al(OH)3,铝离子水解导致明矾溶液呈酸性,水解离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:Al(OH)3; Al3++3H2O?Al(OH)3+3H+;
(3)Al(OH)3?AlO2-+H++H2O①H2O?H++OH-②,①-②可得Al(OH)3+OH-?AlO2-+2H2O,则Al(OH)3溶于NaOH溶液反应的平衡常数=K÷Kw=$\frac{2.0×1{0}^{-13}}{1.0×1{0}^{-14}}$=20,故答案为:20.
点评 本题以Al及其化合物为载体考查元素化合物性质、物质分离提纯,为高频考点,涉及溶解平衡与水电离平衡常数的应用、盐类水解等,中等难度,易错点为III(3)平衡常数的计算.


科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的物质的量相等 | B. | O2比O3的质量小 | ||
| C. | 两种气体的分子数目相等 | D. | 两种气体中的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com