
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是 Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下:
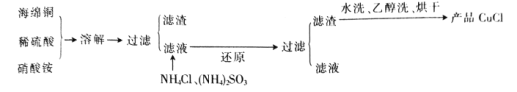
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
____Cu+___+____![]() = _____Cu2++____ NO↑ +___H2O
= _____Cu2++____ NO↑ +___H2O
(2)还原“”过程中,作还原剂的是_________(填化学式);写出“还原”过程中发生反应的离子方程式:_________。
(3)写出氯化亚铜在潮湿的空气中被氧化的化学方程式: ______。
(4)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,并在真空干燥机内于70℃下干燥2 h,冷却密封包装。密封包装的原因是______。
【答案】3 2 8H+ 3 2 4 (NH4)2SO3 2Cu2+ +SO32— +2Cl— +H2O = 2CuCl↓+SO42— +2H+ 4CuCl+O2+4H2O = 2Cu2(OH)3Cl+2HCl 防止CuCl在潮湿的空气中被氧化
【解析】
由流程可知,海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、加入氯化铵氯化发生反应![]() ,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,CuCl水洗、乙醇洗后烘干得到产品CuCl,以此来解答。
,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,CuCl水洗、乙醇洗后烘干得到产品CuCl,以此来解答。
![]() 溶解过程中铜和硝酸根离子发生氧化还原反应,离子方程式为
溶解过程中铜和硝酸根离子发生氧化还原反应,离子方程式为![]() ,故答案为:3;2;
,故答案为:3;2;![]() ;3;2;4;
;3;2;4;
![]() 具有还原性,将Cu2+还原成Cu+和Cl-反应生成CuCl沉淀,结合得失电子守恒、电荷守恒、原子守恒得还原步骤发生反应的离子方程式为
具有还原性,将Cu2+还原成Cu+和Cl-反应生成CuCl沉淀,结合得失电子守恒、电荷守恒、原子守恒得还原步骤发生反应的离子方程式为![]() ,S元素的化合价升高,还原剂为
,S元素的化合价升高,还原剂为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 空气中氧气具有氧化性,作氧化剂,氯化亚铜中铜为+1价,易被氧化成+2价,氯化亚铜作还原剂,又因为氯化亚铜在潮湿的空气中容易被氧化可知:反应物还有水,所以氯化亚铜在空气中被氧化的化学方程式为
空气中氧气具有氧化性,作氧化剂,氯化亚铜中铜为+1价,易被氧化成+2价,氯化亚铜作还原剂,又因为氯化亚铜在潮湿的空气中容易被氧化可知:反应物还有水,所以氯化亚铜在空气中被氧化的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 真空干燥加快乙醇和水的挥发,氯化亚铜在潮湿的空气中容易被氧化可知,密封包装的原因是防止CuCl在潮湿空气中被氧化,故答案为:防止CuCl在潮湿空气中被氧化。
真空干燥加快乙醇和水的挥发,氯化亚铜在潮湿的空气中容易被氧化可知,密封包装的原因是防止CuCl在潮湿空气中被氧化,故答案为:防止CuCl在潮湿空气中被氧化。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
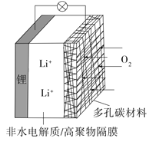
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O
B.Cl2通入水中:Cl2+H2OH++Cl-+HClO
C.铜与浓硝酸反应生成红棕色气体:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乳酸薄荷醇酯( ![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B.煮熟的鸡蛋不能孵化成小鸡原因是蛋白质变性
C.检验某溶液中是否含有乙醛:在盛有2 mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热,看是否产生砖红色沉淀
D.为加快漂白精的漂白速率,使用时可加少量的食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
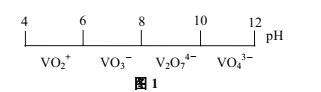
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。
(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
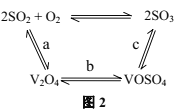
①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
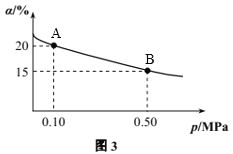
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
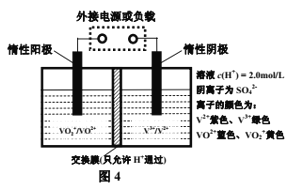
(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,
CO2(g)+H2(g) △H<0,
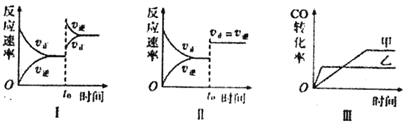
下列分析中正确的是
A. 图I研究的是t0时增大反应物浓度对反应速率的影响
B. 图II中t0时改变的条件只能是增大压强
C. 图III研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D. 图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
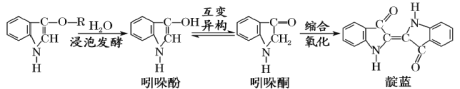
下列说法不正确的是
A.靛蓝的分子式为C16H10N2O2B.浸泡发酵过程发生的反应为取代反应
C.1mol 吲哚酚与H2加成时可消耗4mol H2D.吲哚酚的苯环上的二氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA
B.25℃时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
C.25℃时,0.1mol·L-1Na2S溶液中含有Na+的数目为0.2NA
D.将1mL5.68mol·L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
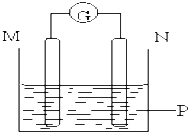
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com