
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收。二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
CO2+![]()
![]()
 +H2O
+H2O
(1)锌基态原子核外电子排布式为_________;写出一种与CO2互为等电子体的分子的化学式:__________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,提供空轨道的是_____(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为______;1mol碳酸乙烯酯中含有的![]() 键数目为______。
键数目为______。
(4)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________;
②甲醛分子的空间构型是______________(用文字描述);
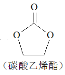
(5)抗坏血酸的分子结构如图 1 所示,推测抗坏血酸在水中的溶解性:______(填“难溶于水”或“易溶于水”) ;一个Cu2O 晶胞(见图 2)中,Cu 原子的数目为______ 。
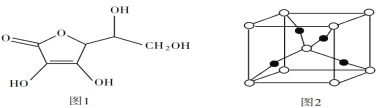
【答案】[Ar]3d104s2或1s22s22p63s23p63d104s2 N2O Zn2+ sp2和sp3 10mol(或10×6.02×1023) 甲醇分子间可形成氢键 平面三角形 易溶于水 4
【解析】
(1)Zn原子核外电子数为30,根据能量最低原理书写核外电子排布式;原子数目和价电子总数相等的微粒互为等电子体;
(2)配离子中中心离子提供空轨道,配体提供孤对电子;
(3)碳酸乙烯酯中酯基中C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,亚甲基中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4;1mol碳酸乙烯酯中含有10mol共价键;
(4)①利用氢键来解释物质的沸点;
②利用杂化类型来分析空间结构;
(5)抗坏血酸中羟基属于亲水基,增大其水解性;依据均摊法计算黑球与白球个数,依据化学式Cu2O判断。
(1)Zn原子核外电子数为30,核外电子排布式为1s22s22p63s23p63d104s2;N2O与CO2的原子数目和价电子数均相等,两者互为等电子体;
(2)Zn2+含有空轨道,H2O含有孤电子对,故Zn2+提供空轨道,H2O提供孤电子对,形成配离子[Zn(H2O)6]2+;
(3)碳酸乙烯酯中酯基中C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化,亚甲基中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4,则碳原子采取sp3杂化;1mol碳酸乙烯酯中含有10mol共价键,含有的σ键数目为:10×6.02×1023=6.02×1024;
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;
②甲醛中碳原子价电子数为3+![]() =3,无孤对电子,则碳原子采取sp2杂化,分子的空间构型为平面三角形;
=3,无孤对电子,则碳原子采取sp2杂化,分子的空间构型为平面三角形;
(5)抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;该晶胞中白色球个数=8×![]() +1=2、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。
+1=2、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2 Na2CO3·3 H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10 H2 O)、H2O2等为原料制备过碳酸钠的工艺流程如下:

已知2CrO42-+2H+=Cr2O72-+H2O , pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。
回答下列问题:
(1)Na2CrO4中Cr元素的化合价为___
(2)Ksp(CaCrO4)___(填“>”或“<”)Ksp(CaSO4)。
(3)流程中循环物质X为___(填化学式)。
(4)步骤II中发生反应的化学方程式为_________
(5)步骤I一III是为了制得纯碱,从环境保护的角度看,可能的不足之处是___
(6)步骤V合成时,加入95%的乙醇的目的是___
(7)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①滴定到终点时,溶液呈___(填“无色”或“浅红色”)。
②过氧化物的活性氧是指过氧化物单独用催化剂催化分解时放出氧气的质量与样品的质量之比。该实验测得的产品中活性氧为___(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“” ___。
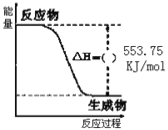
②写出表示丙烷燃烧热的热化学方程式:___。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为___。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)═H2O(l) △H1=Q1kJ/mol
C2H5OH(g)═C2H5OH(l) △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g) △H3=Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/ c(CO32-) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
①标准状况下,它们的密度之比为_____。
②相同物质的量的三种单质中,质子数之比为_____。
③各1g三种单质中,它们的质子数之比为_____。
④同温同压下,1LD2和T2气体中所含中子数之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
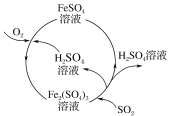
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是( )
A.前2s,以NO2浓度变化表示的平均反应速率为0.005mol·L-1·s-1
B.在2s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4的物质的量为0.25mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
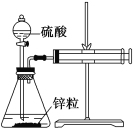
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com