
| A. | c(H+)随着温度的升高而降低 | |
| B. | 35℃时纯水中c(H+)═c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | 向水中加入NaHCO3溶液会抑制水的电离 |
分析 A.水的电离是吸热过程,升高温度,平衡正向移动;
B.35℃时纯水,显中性,故c(H+)=c(OH);
C.向水中加入NaHSO4溶液,NaHSO4电离出氢离子,增大氢离子浓度,平衡逆向移动;
D.向水中加入NaHCO3溶液,NaHCO3电离出碳酸氢根离子,碳酸氢根离子结合氢离子生成碳酸,氢离子浓度减小,平衡正向移动.
解答 解:A.水的电离是吸热过程,升高温度,平衡正向移动,c(H+)随着温度的升高而升高,故A错误;
B.35℃时纯水,显中性,故c(H+)=c(OH-),故B正确;
C.向水中加入NaHSO4溶液,NaHSO4电离出氢离子,增大氢离子浓度,平衡逆向移动,故会抑制水的电离,故C正确;
D.向水中加入NaHCO3溶液,NaHCO3电离出碳酸氢根离子,碳酸氢根离子结合氢离子生成碳酸,氢离子浓度减小,平衡正向移动,故会促进水的电离,故D错误;
故选BC.
点评 本题考查水的电离的影响因素,难度不大.要注意基础知识的积累.


科目:高中化学 来源: 题型:多选题
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯能使溴水褪色 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 葡萄糖分子结构中只有一个醛基,所以是单糖 | |
| D. | 生成高分子化合物的常见反应是加聚反应和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤②④①③⑥ | C. | ④②⑤①③⑥ | D. | ②⑤④③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 用水鉴别己烷、四氯化碳、酒精三种无色液体 | |
| C. | 将苯和溴水混合制取溴苯 | |
| D. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
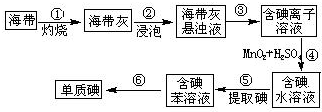 碘在工农业生产和日常生活中有重要用途.
碘在工农业生产和日常生活中有重要用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com