
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
分析 (1)Fe3+具有氧化性,I-具有还原性,二者可发生氧化还原反应生成Fe2+和I2,据此写出反应的离子方程式;
(2)碘单质在有机溶剂苯中的溶解度较大,在水中溶解度较小,加入苯振荡后发生萃取现象,下层几乎为无色,上层为紫色;由于溶液中碘单质较小,则平衡向着正向移动;
(3)淀粉遇到碘单质显示蓝色,据此进行检验;产生特征蓝色沉淀的离子反应方程式是:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;
(4)将表中的三组数据代入公式v=kcm(Fe3+)cn(I-)(k为常数)得m和n的值;
(5)根据反应方程式计算出达到平衡时各组分的浓度,然后结合化学平衡常数表达式及反应2Fe3++2I-=2Fe2++I2进行计算.
解答 解:(1)Fe3+具有氧化性,I-具有还原性,二者可发生氧化还原反应生成Fe2+和I2,反应的离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(2)2mL平衡混合物加入2mL苯充分振荡,苯要萃取平衡混合物中的I2,由于苯的密度比水小,故上层是溶有I2的苯,为紫色,下层溶液中I2的量减小,平衡向正反应方向移动,
故答案为:萃取;分层,上层为紫色(浅紫色到紫红色均可),下层接近无色;正反应方向(或右);
(3)Fe3+和I2水的稀溶液颜色接近,根据碘单质遇到淀粉显示蓝色,可加入淀粉溶液,操作方法及现象为:取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色;取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀,该反应的离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,
故答案为:取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色;3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓
(4)将表中的三组数据代入公式v=kcm(Fe3+)cn(I-)(k为常数)可得:
①0.80m×0.20n=0.032K,
②0.40m×0.60n=0.144K,
③0.20m×0.80n=0.128K,
联立解得:m=1、n=2,
故答案为:1;2;
(5)平衡时c(Fe3+)变为0.01 mol/L,则消耗的铁离子的物质的量为:n(Fe3+)=0.10×2×10-3mol-0.01×4×10-3mol=1.6×10-4mol,
则生成的浓度为:c(Fe2+)=$\frac{1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.04 mol•L-1,
消耗的碘离子的物质的量为:n(I-)=1.6×10-4mol,
平衡时碘离子的浓度为:c(I-)=?$\frac{0.10×2×1{0}^{-3}mol-1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.01 mol•L-1,生成碘单质的浓度为:c(I2)=$\frac{\frac{1}{2}×1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.02mol/L,
再由化学平衡常数公式及反应2Fe3++2I-=2Fe2++I2可知:K=$\frac{0.0{4}^{2}×0.02}{0.0{1}^{2}×0.0{1}^{2}}$=3.2×103,
故答案为:3.2×103.
点评 本题考查化学反应速率的影响、化学平衡及化学平衡常数的计算,题目难度中等,注意掌握化学反应速率及其影响,明确化学平衡、化学平衡常数的计算方法,试题培养了学生的分析能力及化学计算能力.


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
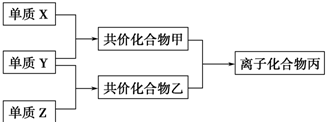
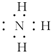 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 11.2L | C. | 16.8L | D. | 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
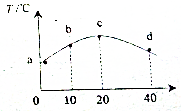 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
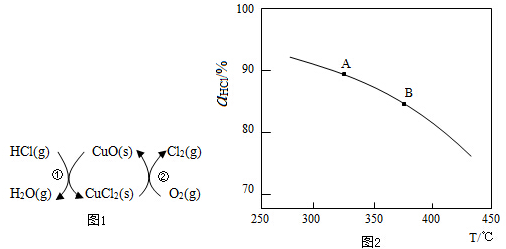
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com