
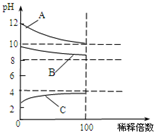
 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH分析 (1)弱酸、弱碱、水都属于弱电解质;根据K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算;
(2)根据CH3COONa 溶液中的水解和电离方程分析;
(3)盐溶液中溶质浓度相同,酸越弱,其盐的酸根水解程度越大,碱性越强,强酸强碱完全电离,弱酸弱碱部分电离;
(4)将 CH3COONa溶液稀释100倍时,pH变化小于2个单位.
解答 解:(1)弱酸、弱碱、水都属于弱电解质,则①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH中属于弱电解质的是①CH3COOH;1mol/L的该溶液中c(H+)=c(CH3COO-),由K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$可得c(H+)=$\sqrt{K}$mol/L;
故答案为:①;$\sqrt{K}$;
(2)CH3COONa 溶液中的水解方程为CH3COO-+H2O?CH3COOH+OH-,电离方程为H2O?H++OH-,则溶液中离子与分子有CH3COOH、H2O、Na+、CH3COO-、H+、OH-,共6种;
故答案为:6;
(3)氢氧化钠是强碱,不水解,相同浓度的溶液氢氧化钠的pH最大,已知酸性:CH3COOH>H2CO3,所以碳酸钠的水解程度大于醋酸钠,碱性顺序:碳酸钠>醋酸钠,醋酸和硝酸均为酸,pH小于7,硝酸为强酸,完全电离,醋酸部分电离,综上知道五种溶液的pH由小到大的顺序是③<①<④<②<⑤,
故答案为:③<①<④<②<⑤;
(4)CH3COONa溶液显碱性,将 CH3COONa溶液稀释100倍时,pH变化小于2个单位,所以B符合;
故答案为:B.
点评 本题考查盐类的水解、弱电解质的电离、电离平衡常数的应用等,注意盐溶液的碱性强弱取决于阴离子的水解能力,当pH相同时,越难水解的盐,其浓度越大,难度中等,侧重于考查学生对基础知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
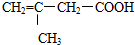 的结构,它不可能发生的反应是( )
的结构,它不可能发生的反应是( )| A. | 与银氨溶液反应析出银 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与新制氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
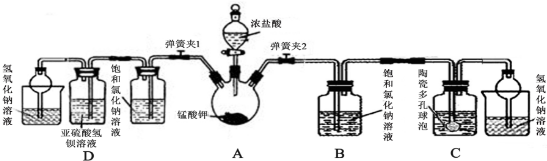
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
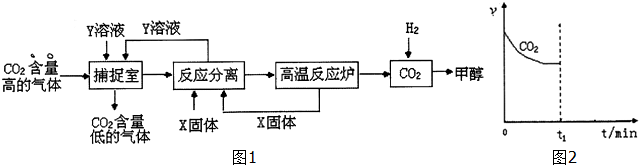
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔点一般比组分金属高 | B. | 合金中只含金属元素 | ||
| C. | 合金的机械性能一般比组分金属好 | D. | 合金的硬度一般比组分小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com