
【题目】
I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3A12O3
27H2O↑+10MgO+3A12O3
(1)写出该化合物作阻燃剂的两条依据____________________________________。
(2)用离子方程式表示除去固体产物中A12O3的原理________________________。
II.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
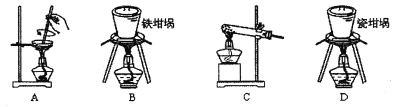
(1)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_______(填选项编号)。
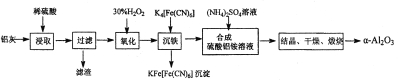
(2)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为____________________。
(3)若用调节溶液的pH“沉铁”,则得到Fe(OH)3,己知:
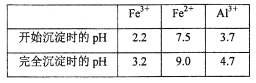
为保证产品的纯度,最好选用下列物质中的_______调节pH(填字母),调节pH的范围为_____。
a.A12O3
B.H2SO4
C.NaOH
D.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置。
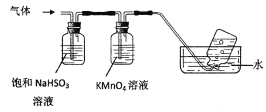
①集气瓶中收集到的气体是_____________________(填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为_________________________________。
【答案】
Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气
(2)Al2O3+2OH-=2AlO2-+H2O
Ⅱ.(1)B
(2)静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁离子,反之,则有。(其它合理答案)
(3)a3.2≤pH<3.7
(4)①N2②2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
试题分析:Ⅰ.(1)2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气;
27H2O↑+10MgO+3Al2O3,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、碱溶于,加入氢氧化钠溶于溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
Ⅱ.(1)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B;
(2)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(3)结合除杂原则,不引入新的杂质,只能选用Al2O3即选项a来调节溶液pH;调节pH的目的是使Fe3+完全沉淀,而Al3+不沉淀,即溶液的pH范围为3.2≤pH<3.7;
(4)①煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)212H2O]═2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,混合气体通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的气体N2采用排水法收集;
②二氧化硫被酸性高锰酸钾溶液氧化而导致KMnO4溶液褪色,二者发生氧化还原反应生成锰离子、硫酸根离子和氢离子,离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol
B.0.25mol
C.0.3mol
D.0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家侯德榜发明的联合制碱法(又称侯氏制碱法)主要原理是:向饱和食盐水中先后通入足量NH3和CO2,生成NaHCO3(在该混合溶液中溶解度较小),加热可得到Na2CO3。某化学小组利用如图装置进行模拟实验,A、B、C、D为备选装置。
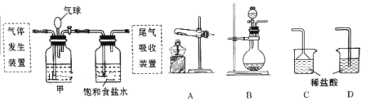
请填写下列空白:
(1)联合制碱法制取NaHCO3的化学方程式为。
(2)用石灰石和盐酸制取CO2时应选用的气体发生装置为(填字母代号,下同),该反应的离子方程式为;若制NH3选用与实验室制取CO2相同的发生装置,则应选择的试剂为(填试剂的名称)。
(3)按照如图所示的装置制备NH3,并充入NH3来制备饱和氨盐水,应选用的尾气吸收装置为(填字母代号);甲装置的作用为;该实验过程中应先通入后通入,其原因是。
(4)反应一段时间后,饱和氨盐水中析出NaHCO3晶体,从中得到纯净NaHCO3并进一步制得Na2CO3的操作名称依次是、。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于组成细胞的元素组成叙述正确的是( )
A. C元素因其在细胞的干重中含量最高,所以C是生命的最基本元素
B. C原子构成的碳链是生物大分子的骨架
C. C、H、O、N是蛋白质和糖类中共有的4种元素
D. 构成细胞的微量元素就是指细胞中含量很少且可有可无的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) △H> 0请回答下列问题
P(g)+Q(g) △H> 0请回答下列问题
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol/L,c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为____________
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol/L,c(N)=amol/L;达到平衡后,c(P)=2mol/L,a=____________
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol/L,达到平衡后,M的转化率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度缩小
C. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较
D. 蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用自来水制备蒸馏水的实验装置图。
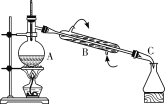
实验室蒸馏装置
(1)填写仪器名称:A:______________; B:________________; C:________________。
(2)图中有一处错误,请指出:________________________。
(3)蒸馏时,瓶中要先加几块沸石,其目的是________________。
(4)蒸馏时,取________℃的产品即可获得蒸馏水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com