
| A. | 绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来 | |
| B. | 物质发生化学反应过程中一定伴随着能量变化 | |
| C. | 可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能 | |
| D. | 化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
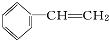 分子中,处于同一平面上的原子数最多可能16个.
分子中,处于同一平面上的原子数最多可能16个.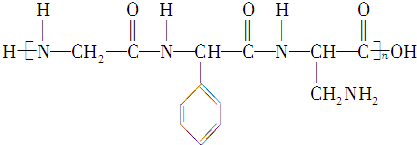
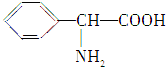 、
、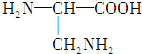 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
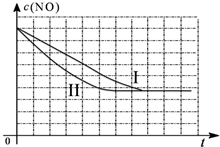
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
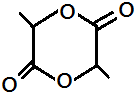 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、OH-、H3O+ | B. | Na+、Mg2+、S2- | C. | F-、NH2-、Cl- | D. | Li+、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力强 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 碳酸钡和硫酸钡都可以用做钡餐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
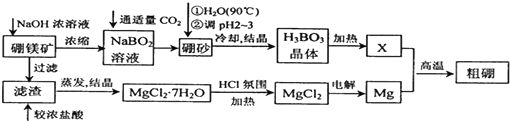
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com