
【题目】将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是( )
A. 两种气体都被吸收,并有BaSO4沉淀生成
B. 只生成BaSO3沉淀,SO3从溶液中逸出
C. 生成BaSO3和BaSO4两种沉淀
D. 只有BaSO4沉淀,SO2通入溶液中无沉淀生成
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列各项中表达正确的是( )
A. 第VⅡA族元素形成的氢化物中沸点最高的是HI
B. 水分子很稳定性是因为水分子间易形成氢键
C. 用电子式表示HCl形成过程:![]()
D. 第三周期元素形成的简单离子中,半径最小的是Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,遇到盐酸或强碱溶液都能反应的一组是
A.Cu Al2O3NaHCO3B.Mg Al(OH)3Na2CO3
C.Fe Al2O3Al(OH)3D.Al NaHCO3Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的事实是( )
A. Cl2与H2S溶液发生置换反应
B. 受热时H2S能分解,HCl则不能
C. 硫和Cl2分别与氢气化合时, Cl2比硫更容易
D. 溶于水时HCl是强酸,H2S是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
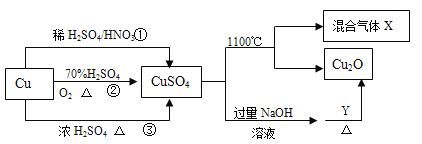
A. Y可以是葡萄糖
B. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
C. 相对于途径①、③,途径②更好地体现了绿色化学思想
D. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取O2。下列有关说法不正确的是
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A. 反应①是人们获取H2的途径之一
B. 反应②、③都是化学能转化为热能
C. 反应H2O2(l)=H2O(g)+ ![]() O2(g)的ΔH=-98.2 kJ·mol-1
O2(g)的ΔH=-98.2 kJ·mol-1
D. 反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
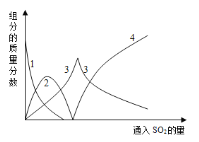
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Licht等科学家设计的Al—MnO4—电池原理如图所示,电池总反应为Al+MnO4—===AlO2—+MnO2,下列说法正确的是( )
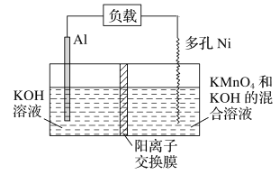
A. 电池工作时,K+向负极区移动
B. Al电极发生还原反应
C. 正极的电极反应式为MnO4—+4H++3e-===MnO2+2H2O
D. 理论上电路中每通过1mol电子,负极质量减小9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com