
【题目】25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
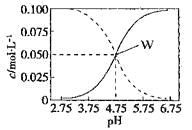
A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
【答案】C
【解析】
A.pH=4的溶液,醋酸的电离大于醋酸钠的水解,溶液呈酸性,A正确;
B.根据电荷守恒有c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),该点有c(CH3COOH)=c(CH3COO-),所以c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)成立,故B正确;
C.W点处于醋酸的电离平衡和醋酸根的水解平衡的两个平衡体系,将此时1.0L溶液稀释到10L,稀释过程中会伴随醋酸的进一步电离和醋酸根的进一步水解,所以用pH计测量,pH增大的幅度小于1,溶液的pH不可能为5.75,C错误;
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1molL-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1molL-1,故D正确;
故答案选C。


科目:高中化学 来源: 题型:
【题目】绿原酸的结构简式如下图,则下列有关绿原酸的说法不正确的是
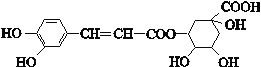
A. 分子式为C16H18O9
B. 既可以与氢气发生加成反应,又可以使酸性KMnO4溶液褪色
C. 还能发生取代、加聚、消去等反应
D. 在镍做催化剂的情况下,1 mol绿原酸发生加成反应最多可消耗6 mol 氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B![]() C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
A.若B是气体,增大A的浓度会使B的转化率增大
B.若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C.升高温度,C质量分数减少,说明正反应为放热反应
D.增大压强,平衡不移动,说明B、D一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023
B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =0.1 mol/L
C.1 L 0.1 mol/L NH4Cl溶液中的NH![]() 数是0.1×6.02×1023
数是0.1×6.02×1023
D.标准状况下2.24 L Cl2中含有0.2 mol 共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分。已知a原子的最外层电子数比次外层电子数少3,下列说法中不正确的是
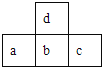
A. 元素c的含氧酸一定是强酸
B. 元素a、d的原子半径:a>d
C. 元素b在自然界中存在游离态
D. 元素b、c的阴离子半径:b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com