
| A、CO2 和 NO2 |
| B、H2S 和 H2O |
| C、NH4+ 和 H2O |
| D、N2 和 C2H4 |


科目:高中化学 来源: 题型:
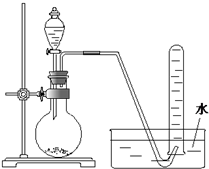
| A、用H2O2溶液和MnO2反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用稀硫酸与石灰石反应制取CO2 |
| D、用NH4Cl和Ca(OH)2反应制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
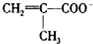 )、Cl-、H2O形成的配合物为
)、Cl-、H2O形成的配合物为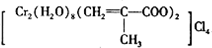 .
.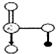 是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是
是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是查看答案和解析>>
科目:高中化学 来源: 题型:
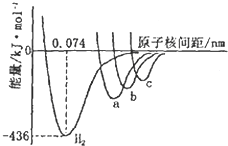 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
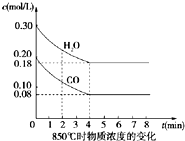 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com