
�״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) CH3OH��g��+H2O(g) ��H2
CH3OH��g��+H2O(g) ��H2
��CO2(g)+H2(g) CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
| ��ѧ�� | H��H | C��O | C | H��O | C��H |
| E/��kJ.mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼����H1�� kJ��mol-1����֪��H2��-58kJ��mol-1�����H3�� kJ��mol-1��
��2����Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ ��ͼ1�� ����ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ �������߱����ĸ�������ж������� ��
����ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ �������߱����ĸ�������ж������� ��

��3���ϳ��������n(H2)/n(CO+CO2)��2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ������CO��ֵ���¶����߶� �������С��������ԭ���� ��ͼ2�е�ѹǿ�ɴ�СΪ_____�����ж�������_____��
���𰸡���1����99����41��2�� ��a����Ӧ��Ϊ���ȷ�Ӧ��ƽ�ⳣ��Ӧ���¶����߱�С��
��a����Ӧ��Ϊ���ȷ�Ӧ��ƽ�ⳣ��Ӧ���¶����߱�С��
��3����С�������¶�ʱ����Ӧ��Ϊ���ȷ�Ӧ��ƽ���������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO���������ܽ�������¶����ߣ�ʹCO��ת���ʽ��ͣ�P3��P2��P1����ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת��������
 �����㶨λ��������Ҫ�ǿ��鷴Ӧ�ȼ��㡢��˹����Ӧ�á�ƽ�ⳣ���Լ����������ƽ��״̬��Ӱ���
�����㶨λ��������Ҫ�ǿ��鷴Ӧ�ȼ��㡢��˹����Ӧ�á�ƽ�ⳣ���Լ����������ƽ��״̬��Ӱ���
����ʦ���硿�����֪ʶ�Ͽ������Ȼ�ѧ����ʽ����˹���ɣ�ƽ��ͼ����������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�죬������ѧ����֪ʶ���⡢�ۺ��������������Ȼ�ѧ����ʽ����˹���ɣ�ƽ��ͼ����������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�죬̼�������仯��������ʵ�֪ʶͬ��̼���á�������������յȻ���������ϵ���������������ѧ�����õ�Ŀ�ģ���ͻ���˻�ѧ��һ��ʵ���Ե�ѧ�Ƶ��ص㡣


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ӫ�������������ڷ����ı仯������˵�����������������������ȷ����(����)
A������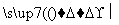 ������
������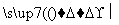 CO2��H2O(�ͷ�����ά�������)
CO2��H2O(�ͷ�����ά�������)
B������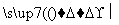 ������
������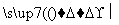 CO2
CO2 ��H2O(�ͷ�����ά�������)
��H2O(�ͷ�����ά�������)
C����֬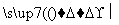 ���ͺ�֬����
���ͺ�֬����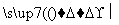 CO2��H2O(�ͷ�����ά�������)
CO2��H2O(�ͷ�����ά�������)
D��������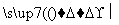 ������ϳ���������ĵ�����(������������)
������ϳ���������ĵ�����(������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
10mlŨ��Ϊ1mol/L�������������п�۷�Ӧ��������������������Һ���ܼ�����Ӧ���ʵ��ֲ�Ӱ���������ɵ��ǣ� ��
A��K2SO4 B��CH3COONa C��CuSO4 D��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
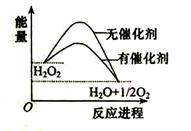 ��֪H2O2�ڴ��������·ֽ����ʼӿ죬�������淴Ӧ���̵ı仯����ͼ��ʾ������˵����ȷ���ǣ� ��
��֪H2O2�ڴ��������·ֽ����ʼӿ죬�������淴Ӧ���̵ı仯����ͼ��ʾ������˵����ȷ���ǣ� ��
A�������������С�˷�Ӧ����ЧӦ
B����������������H2O2��ƽ��ת����
C��H2O2�ֽ���Ȼ�ѧ����ʽ��H2O2 �� H2O + O2 + Q
D����Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ͻ�������Ͼ�����������������ܣ���������ܵĿ���������Ҫ���á�
��1��һ���¶��£�ij����Ͻ�M�������������ͼ��ʾ������Ϊƽ��ʱ������ѹǿ��p���������ʾ��������ԭ�������ԭ�ӵĸ����ȣ�H/M����
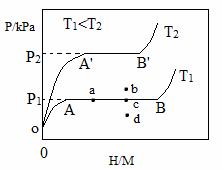
��OA�Σ����ܽ���M���γɹ�����MHx����������ѹǿ������H/M���������AB�Σ�MHx�����������⻯��Ӧ�����⻯��MHy���⻯��Ӧ����ʽΪ��zMHx(s)+H2(g)==ZMHy(s) ��H(��)����B�㣬�⻯��Ӧ��������һ����������ѹǿ��H/M�������䡣��Ӧ������z=_____���ú�x��y�Ĵ���ʽ��ʾ�����¶�ΪT1ʱ��2gij�Ͻ�4min����������240mL����������v=______mL•g-1•min����Ӧ���ʱ��H��_____0���>����<����=������
��2���DZ�ʾ��λ��������Ͻ����⻯��Ӧ�ε����������ռ�����������ı��������¶�ΪT1��T2ʱ������T1��____����T2�����>����<����=����������Ӧ������ͼ��a��ʱ�������¶Ȳ��䣬�������ϵ��ͨ�������������ﵽƽ���Ӧ�����ܴ���ͼ�е�_____�㣨�b����c����d������������Ͻ��ͨ��______��_______�ķ�ʽ�ͷ�������
��3������Ͻ�ThNi5�ɴ���CO��H2�ϳ�CH4�ķ�Ӧ���¶�ΪTʱ���÷�Ӧ���Ȼ�ѧ����ʽΪ_________����֪�¶�ΪTʱ��CH4(g)+2H2O=CO2(g)+4H2(g) ��H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41KJ•mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ˮ�ͱ��������ܣ��������Ʒ�Ӧ�����ձ��м�ˮ�ͱ����ܶȣ�0.88g/cm3����50mL����һС�������ƣ��ܶȣ�0.97g/cm3��Ͷ���ձ��У��۲쵽����������ǣ���
| A�� | ����ˮ���з�Ӧ���Ĵ��ζ� | |
| B�� | ��ͣ���ڱ����в�������Ӧ | |
| C�� | ���ڱ���Һ���Ϸ�Ӧ���Ĵ��ζ� | |
| D�� | ���ڱ���ˮ�Ľ��洦��Ӧ���������ϡ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������CO2ͨ��V L NaOH��Һ�У���֪NaOH��ȫ��Ӧ�����ڷ�Ӧ�����Һ�м�������ʯ��ˮ���õ�a g���������ڷ�Ӧ�����Һ�м�������CaCl2��Һ���õ�b g������������˵����ȷ���ǣ���
| A�� | �μӷ�Ӧ��CO2�����Ϊ0.224a L | |
| B�� | ���������ݲ���ȷ��NaOH��Һ�����ʵ���Ũ�� | |
| C�� | ��a=b����CO2��NaOH��Һ��Ӧ�IJ�����ֻ��Na2CO3 | |
| D�� | b���ܵ���a��С��a�����a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ǿ����ǿ����ϡ��Һ�ﷴӦ���к��ȿɱ�ʾΪ
H��(aq)��OH��(aq)===H2O(l) ��H����57.3 kJ��mol��1
�����з�Ӧ��
CH3COOH(aq)��NaOH(aq)===CH3COONa(aq)��H2O(l)����H����Q1 kJ��mol��1
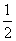 H2SO4(Ũ)��NaOH(aq)===
H2SO4(Ũ)��NaOH(aq)===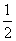 Na2SO4(aq)��H2O(l)����H����Q2 kJ��mol��1
Na2SO4(aq)��H2O(l)����H����Q2 kJ��mol��1
HNO3(aq)��NaOH(aq)===NaNO3(aq)��H2O(l)
��H����Q3 kJ��mol��1
������Ӧ������Һ�н��У�������Q1��Q2��Q3�Ĺ�ϵ��ȷ����(����)��������������������������������
A��Q2>Q3>Q1 B��Q2>Q1>Q3 C��Q1��Q2��Q3 D��Q2��Q3>Q1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������л�����ijЩҩ���е���Ч�ɷ֡�
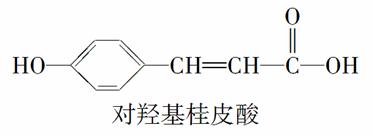
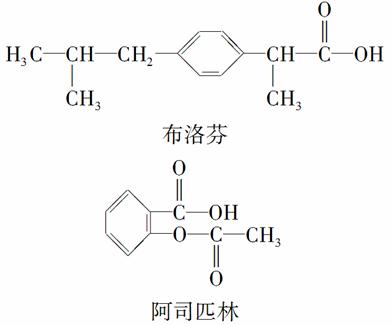
����˵����ȷ����(����)
A�������л��ﶼ�ܷ���ˮ�ⷴӦ
B�������л��ﱽ���ϵ���ԭ��������ԭ��ȡ������һ�ȴ��ﶼֻ��2��
C���������ʵ������������ʼ�������������Һ�У����ǻ���Ƥ�����������������
D��ʹ��FeCl3��Һ��ϡ������Լ����������л���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com