
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4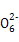 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。 科目:高中化学 来源: 题型:填空题
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为 。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是 ,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向NaBr和KI的混合溶液中,通入足量的Cl2后,将溶液蒸干并灼烧,最后蒸发皿中剩余的物质是________,写出反应的化学方程式:________________________________。
(2)向KI溶液中滴入淀粉溶液,现象是____________________,再滴入氯水,现象是________,有关反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理: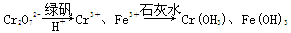
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是 。
(2)用MnO2制KMnO4的工艺流程如图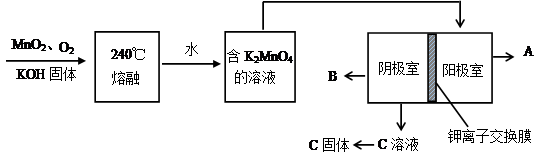
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (写化学式,下同),可以循环使用的物质是 。
④钾离子交换膜的一种材料是聚丙烯酸钾(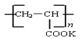 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是 (精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示: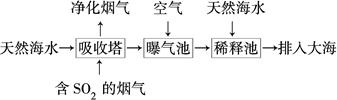
①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。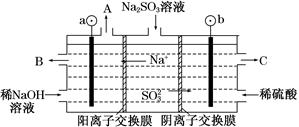
①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com