
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N��H2��/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N��NH3��/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
���� ��1���ٰ����ĺϳ��Ƿ��ȵġ������С�Ŀ��淴Ӧ���¶ȸߣ�������߷�Ӧ���ʣ���ƽ�������ƶ���ͬʱ�ڸ��¶���ø�Ļ������
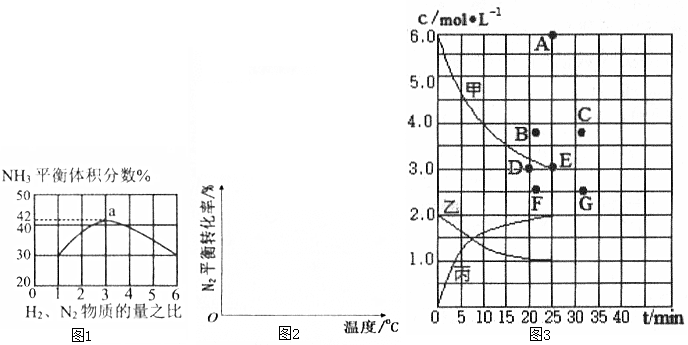
�ڸ���ͼ1��֪H2��N2��Ͷ�ϱ�Ϊ3��ƽ��ʱNH3�������Ϊ42%����H2���ʵ���Ϊ3amol��N2���ʵ���Ϊamol��N2ת�������ʵ���Ϊx������ƽ��������������NH3�����������������ʵ����ʵ������Ӷ����ƽ�����������N2��H2��ʼ���ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ƽ��ʱN2��H2���ʵ���Ũ��֮�ȵ��ڻ�ѧ������֮�ȣ�ת������ȣ�
��2���ϳɰ���ӦΪ���ȷ�Ӧ�������¶ȣ�ת���ʼ�С���ݴ˻����仯ͼ��
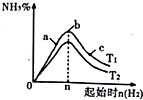
��3�����ɱ���֪����֪25min��Ӧ��ƽ��״̬��
N2��g��+3H2��g��?2NH3��g����
����mol/L����2 6 0
�仯��mol/L����1 3 2
ƽ�⣨mol/L����1 3 2
��ʱƽ�ⳣ��Ϊ��K=$\frac{{2}^{2}}{{3}^{3}��1}$=$\frac{4}{27}$��
�ڸ���Qc��K�Ĵ�Сƽ���ж����淴Ӧ���ʵĴ�С��
���ɷ�Ӧ����ʽ��֪��N2��g��+3H2��g��?2NH3��g���仯��֮�ȵ��ڶ�Ӧ���ʵĻ�ѧ������֮�ȣ�����n�ף���n�ң���n��=3��1��2�����Ա�ʾc��N2����t���������ң��ڴ��¶��£�����ʼ����4molN2��12molH2���൱����ԭ������������ѹǿ��ƽ�������ƶ������Ա�ԭƽ�������С�����Ҵ�ƽ���ʱ�����̣�
��4����֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g��?2H2O��l����H=-571.6kJ•mol-1��
�ɸ�˹���ɣ��١�2-�ڡ�3��2N2��g��+6H2O��l��?4NH3��g��+3O2��g�����ݴ˷�����
��� �⣺��1���ٰ����ĺϳ��Ƿ��ȵġ������С�Ŀ��淴Ӧ���¶ȸߣ�������߷�Ӧ���ʣ���ƽ�������ƶ���ͬʱ�ڸ��¶���ø�Ļ���������Թ�ҵ�Ϻϳɰ����¶�һ�������500�棬ԭ���Ǹ��¶��´����Ļ�����ã�
�ʴ�Ϊ�����¶��´����Ļ�����ã�
�ڸ���ͼ1��֪H2��N2��Ͷ�ϱ�Ϊ3��ƽ��ʱNH3�������Ϊ42%����H2���ʵ���Ϊ3amol��N2���ʵ���Ϊamol��N2ת�������ʵ���Ϊx����
N2+3H2?2NH3
��ʼ��mol�� a 3a 0
��Ӧ��mol�� x 3x 2x
ƽ�⣨mol�� a-x 3a-3x 2x
��$\frac{2x}{a-x+3a-3x+2x}$��100%=42%�����x=0.592a����N2��ƽ���������=$\frac{a-0.592a}{4a-2��0.592a}$��100%=14.5%��
N2��H2��ʼ���ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ƽ��ʱN2��H2���ʵ���Ũ��֮�ȵ��ڻ�ѧ������֮��Ϊ1��3��ת������ȣ�������ת����֮��Ϊ1��1��
�ʴ�Ϊ��14.5%��1��1��
��2���ϳɰ���ӦΪ���ȷ�Ӧ�������¶ȣ�ת���ʼ�С���ݴ�ͼ��Ϊ�� ��
��
�ʴ�Ϊ�� ��
��
��3�����ɱ���֪����֪25min��Ӧ��ƽ��״̬��
N2��g��+3H2��g��?2NH3��g����
����mol/L����2 6 0
�仯��mol/L����1 3 2
ƽ�⣨mol/L����1 3 2
��ʱƽ�ⳣ��Ϊ��K=$\frac{{2}^{2}}{{3}^{3}��1}$=$\frac{4}{27}$��
�ʴ�Ϊ��$\frac{4}{27}$��
�ڸ���Qc=$\frac{{3}^{2}}{{3}^{3}��3}$=$\frac{3}{27}$��K������ƽ�������ƶ�������ʱv������v����
�ʴ�Ϊ�����ڣ�
���ɷ�Ӧ����ʽ��֪��N2��g��+3H2��g��?2NH3��g���仯��֮�ȵ��ڶ�Ӧ���ʵĻ�ѧ������֮�ȣ�����n�ף���n�ң���n��=3��1��2�����Ա�ʾc��N2����t���������ң��ڴ��¶��£�����ʼ����4molN2��12molH2���൱����ԭ������������ѹǿ��ƽ�������ƶ������Ա�ԭƽ�������С�����Ҵ�ƽ���ʱ�����̣���Ӧ�ǵ�B��
�ʴ�Ϊ���ң�B��
��4����֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g��?2H2O��l����H=-571.6kJ•mol-1��
�ɸ�˹���ɣ��١�2-�ڡ�3��2N2��g��+6H2O��l��?4NH3��g��+3O2��g������H=��-92.4kJ•mol-1����2-��-571.6kJ•mol-1����3=+1530 kJ•mol-1��
�ʴ�Ϊ��+1530 kJ•mol-1��
���� ���⿼���˻�ѧƽ��Ӱ�����ط�����ƽ�����Ӧ�ã�ע�ⷴӦ�����ļ���Ӧ�ã�ͼ����ƣ����ջ����ǹؼ�����Ŀ�ѶȽϴ�


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ڽ�����ϵ | |
| B�� | ������������Ҫ���������� | |
| C�� | ���ξ����ܽ⡢���ˡ�������õ����Ǵ�����ʳ�� | |
| D�� | NH4NO3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ������ͼ������������ȷ����
�����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ������ͼ������������ȷ����| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/min | ƽ��ʱ�������仯 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| ��һ�� | X��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | �ų�Q1kJ |
| �ڶ��� | X��HI�� | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | ����Q2kJ |
| A�� | Q1+Q2=11a��a��0�� | |
| B�� | k��=K•k����KΪ��֪��Ӧ��ƽ�ⳣ������ͬ�� | |
| C�� | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D�� | ��ͬ�¶��£��ڵڶ���ƽ���Ļ���������ټ���2molHI�����´ﵽƽ���HI��ת����Ϊ21.6% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 | c��NH3��/mol•L-1 | c��O2��/mol•L-1 | c��NO��mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | �� | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1 min�ڵ�ƽ������Ϊv��H2��=$\frac{0.40}{{t}_{1}}$mol/��L•min�� | |
| B�� | ���������������䣬��ʼʱ�������г���0.60 mol CO��1.20 mol H2������ƽ��ʱ��n��CO2��=0.40 mol | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.20 mol CO����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת���ʼ�С��H2���������Ҳ��С | |
| D�� | �¶�����800�棬������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�AgCl��ͬ���ʵ���Ũ�ȵ�AgNO3��NaCl��Һ�е��ܽ�ȱȽϣ�ǰ�ߴ� | |
| B�� | �����£�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������Ϻ��γ���Һa�������ʵ���Ũ�ȵ�������NaOH��Һ�������Ϻ��γ���Һb��ˮ�ĵ���̶�a��b | |
| C�� | ��������CO2ͨ��0.1 mol•L-1Na2CO3��Һ������Һǡ�ó����ԣ�����Һ�У���������Һ����仯��2c��CO32-��+c��HCO3-��=0.1 mol•L-1 | |
| D�� | �����£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw�����У�Ka•Kh=Kw |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
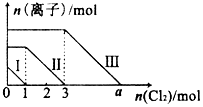 �����Fe2+��I-��Br-����Һ��ͨ����������������Һ���������ӵ����ʵ����������������ʵ����ı仯��ͼ��ʾ������˵������ȷ���ǣ�������
�����Fe2+��I-��Br-����Һ��ͨ����������������Һ���������ӵ����ʵ����������������ʵ����ı仯��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | �߶����Fe2+�ı仯��� | B�� | ԭ�����Һ��n��FeBr2��=4mol | ||
| C�� | �߶����Br-�ı仯��� | D�� | aֵ����6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com