
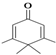
 如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )
如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )| A. | Penguinone中存在两种官能团 | |
| B. | Penguinone是一种芳香醛 | |
| C. | Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质 | |
| D. | 如果该分子中的双键都能加成,则1 mol Penguinone能与3 mol氢气反应 |
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
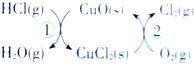 示).
示).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


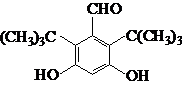
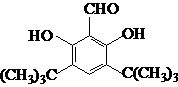
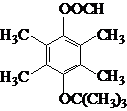 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①中阴极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中a为负极,发生的电极反应式为H2+2OH-+2e-═2H2O | |
| D. | 装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
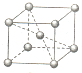 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com