
A、
| ||
B、
| ||
C、
| ||
D、
|
| n |
| V |
| 2ymol-4xmol |
| aL |
| 2y-4x |
| a |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、该溶液中含有NaOH4g |
| B、100ml该溶液中含有Na+0.01mol |
| C、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol/L |
| D、在1L水中溶解4g NaOH即可配制得0.1 mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | 5.61×10-11 |
| A、氯水中加入少量NaHCO3粉末:HCO3-+H+=H2O+CO2↑ |
| B、NaAl(OH)4溶液中通入足量的CO2:Al(OH)4-+CO2=Al(OH)3↓+HCO3- |
| C、NaClO溶液中通入少量CO2:2ClO-+H2O+CO2=CO32-+2HClO |
| D、Na2CO3溶液中通入少量SO2:2 CO32-+H2O+SO2=SO32-+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4、纯碱、食盐 |
| B、HI、烧碱、胆矾 |
| C、H2CO3、乙醇、醋酸钠 |
| D、H3PO4、熟石灰、苛性钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
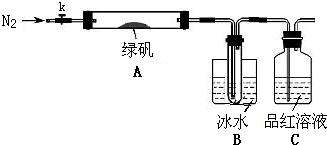 某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.
某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.查看答案和解析>>
科目:高中化学 来源: 题型:
A、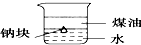 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、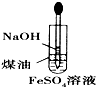 制备Fe(OH)2 |
C、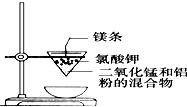 制取金属锰 |
D、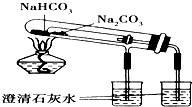 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com