
(20分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+ H2O =Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第④步中的沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
20.(1)Mg、Cu、Fe OH-、AlO2-、SiO32- (2)Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+
(3)坩埚、泥三角、(坩埚钳)(4)白色絮状沉淀迅速转化成灰绿色沉淀最后转化成红褐色沉淀。
FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4 Fe(OH)2+O2+2 H2O = 4 Fe(OH)3
(5)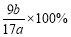 (6) C D
(6) C D
【解析】
试题分析:(1)铁、铝、镁、铜、硅与氢氧化钠反应的只有铝、硅,生成偏铝酸钠、硅酸钠,氢氧化钠有剩余,则固体A的成分是Mg、Cu、Fe ,溶液M中的阴离子有: OH-、AlO2-、SiO32-,
(2)铝盐在过量氨水中形成沉淀,生成沉淀的离子方程式为:Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+
(3)步骤④为灼烧装置,用到的仪器有三脚架、酒精灯以及坩埚、泥三角、坩埚钳;
(4)在空气中将NaOH溶液滴入FeCl2溶液中,生成氢氧化亚铁,氢氧化亚铁不稳定,能被空气中的氧气氧化,观察到的现象是白色絮状沉淀迅速转化成灰绿色沉淀最后转化成红褐色沉淀;反应的化学方程式是FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4 Fe(OH)2+O2+2 H2O = 4 Fe(OH)3
(5)整个流程根据铝原子守恒得关系式为2Al—Al2O3,该样品中铝的质量分数为
{[(b/102)×2×27]÷a}×100%=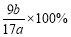
(6)下列因操作不当,A.第①步中加入NaOH溶液不足,导致铝元素不能完全反应,会使测定结果偏小,B.第②步中加入盐酸不足时,会使铝元素损失,测定结果偏小,C.第④步中的沉淀未用蒸馏水洗涤,导致氢氧化铝质量增大,测定结果偏高,D.第④步对沉淀灼烧不充分,还有一部分氢元素存在,导致结果偏高,选CD。
考点:考查混合物中物质含量的测定。


科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法中正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA
B.22.4L NH3中含有的原子总数为4NA
C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA
D.常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:选择题
短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子M层电子数是K层电子数的3倍;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
A.C>D>B>A B.D>B>A>C C.A>D>C>B D.B>A>C>D
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:简答题
【化学---选修3物质结构与性质】15分
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区 I-的最外层电子排布式为
(2)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(3)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。A.CsICl2=CsCl+ICl B.CsICl2 =CsI +Cl2
(4)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,
发生化学反应的化学方程式为
(5)ClO2—的空间构型为 型,中心氯原子的杂化轨道类型为 ,
(6)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,距离最近且相等的两个Ca2+核间距为a cm,则CaF2的摩尔质量为

查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:选择题
在100 mL混合溶液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1 mol/L,向该混合液中加入1.92g铜,加热后,所得溶液中Cu2+的浓度是
A.0.15mol/L B.0.225 mol/L C.0.35mol/L D.0.45mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
在下图点滴板上有四组溶液间反应的小实验,其对应的离子方程式书写不正确

A.a反应:Fe3+ + 3SCN-=Fe(SCN)3 B.b反应:HCO3-+ OH-=CO32-+ H2O
C.c反应:Al2O3+2OH-=2AlO2-+H2O D.d反应:Fe2++ 2H++ H2O2=Fe3++ 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水溶液中: H+、I―、NO3―、SiO32-
B.水溶液中:Cl-、NO3-、Na+、SO32-
C.将足量CO2通入时:H+、NH4+、AlO2-、SO42-
D.碱性溶液中:NO3-、I-、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
关于基本营养物质的说法正确的是
A.所有蛋白质均可通过颜色反应来鉴别
B.葡萄糖和蔗糖不是同分异构体,但属于同系物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列化学事实的描述或解释正确的是
A.Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)===c(OH-)
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-==CO32-+H2O
C.有些化学反应既属于复分解反应又属于氧化还原反应
D.常温下,将pH=3的HA和PH=11的BOH等体积混合后PH>7,可能生成了弱酸强碱盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com