
 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
分析 (1)A.△H=生成物标准生成热综合-反应物标准生成热总和,结合表格中数据计算;
B.由盖斯定律可知Ⅱ-Ⅲ得到CO(g)+2H2(g)?CH3OH(g)△H1;
(2)A.对比a、c可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动;
B.b等效为a中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动;
C.a中温度高,反应速率快;
D.容器a中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)=$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,比较K与Qc;
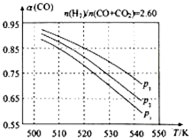
(3)①由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动;
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是装置简单,减小了电池的体积,负极甲醇失电子得到二氧化碳.
解答 解:(1)A.反应Ⅰ、CO(g)+2H2(g)?CH3OH(g)△H1=-201.25KJ/mol-(-110.52KJ/mol)-0=-90.73 kJ/mol,
故答案为:-90.73 kJ/mol;
B.Ⅱ、CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol,
Ⅲ、CO2(g)+H2(g)?CO(g)+H2O(g)△H3,
盖斯定律计算Ⅱ-Ⅲ得到CO(g)+2H2(g)?CH3OH(g)△H=(-58kJ/mol-△H3)=-90.73 kJ/mol,△H3=+32.73KJ/mol,则△H3>0,
故答案为:>;
(2)A.对比a、c可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,故A正确;
B.b等效为a中平衡基础上压强增大一倍,反应气体体积不变,平衡不移动,容器a中的CH3OH体积分数与容器b中的相等,故B错误;
C.a中温度高,反应速率快,到达平衡时间更短,故C错误;
D.容器a中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)=$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器a中化学平衡常数K1=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行,故D正确,
故答案为:AD;
(3)①由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小,
故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3,
故答案为:P1>P2>P3;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高;
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是装置简单,减小了电池的体积,负极甲醇失电子得到二氧化碳,结合电荷守恒书写电极反应CH3OH-6e-+H2O=CO2+6H+,
故答案为:装置简单,减小了电池的体积;CH3OH-6e-+H2O=CO2+6H+.
点评 本题考查化学平衡的计算,为高频考点,把握盖斯定律应用、K与Qc的计算、平衡移动、原电池等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
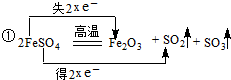 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 表1 | 表2 | |||
| 物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
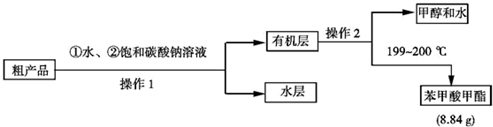
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应 | |
| B. | 氢氧燃料电池使用时是将热能转化成电能 | |
| C. | 人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 | |
| D. | 太阳能光电池将太阳能直接转换为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 使用容量瓶时,先检验其是否漏水,然后洗净后,不用干燥即可使用 | |
| C. | 可用10mL量筒量取8.58mL蒸馏水 | |
| D. | 在配制溶液定容后,上下翻转摇匀后发现液面下降,须加水至溶液凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Cl- K+ SO42- | B. | Na+ NO3 - OH - CO3 2- | ||
| C. | Ba2+ Cl- NO3 - SO4 2- | D. | K+ Na+ Cl- SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下.22.4L水含有NA个水分子 | |
| B. | 1mol/LNa2C03溶液中含有Na+数目为2NA | |
| C. | 常温常压下,22.4L02中含有2NA个氧原子 | |
| D. | 169O2和O3的混合气体中含氧原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com