
| X | ||
| M |
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
 ,故答案为:
,故答案为: ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 催化剂 |
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
| 催化剂 |
| c2(CO2).c(N2) |
| c2(CO).c2(NO) |
| 0.4mol×2mol |
| 1mol |
| 0.8mol |
| 1mol |


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
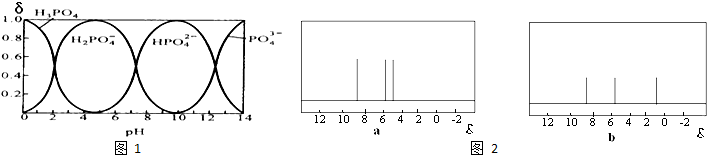
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.查看答案和解析>>
科目:高中化学 来源: 题型:
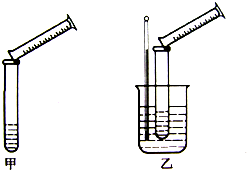 硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略) | 实验组号 | 温度 | Na2S2O3 | H2SO4 | 加入H2O 的体积 | 出现沉淀 所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 4s |
| Ⅳ | 30℃ | 5mL | 0.2mol/L | 5mL | 0.2mol/L | 10mL | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.5 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
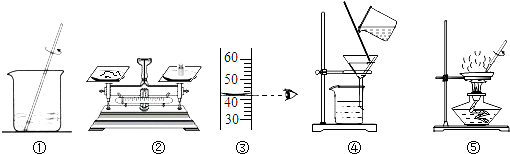
| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、②③ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
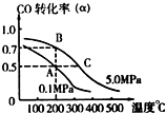 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com