
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 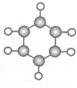 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
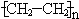 .
. .
.分析 A使溴的四氯化碳溶液褪色,含有不饱和键,结合其比例模型可知,A为CH2=CH2,A能与水在一定条件下反应生成C,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,故C为CH3CH2OH,根据B的组成元素及其球棍模型知,B是苯.结构简式为 ;D由C、H、Br三种元素组成,D的相对分子质量比物质C小2,即为109,所以D是CH3CH2Br;E由C、H、O三种元素组成,E和C反应生成相对分子质量为100的酯,说明E含有羧基,结合E的球棍模型可知E为CH2=CHCOOH,据此解答.
;D由C、H、Br三种元素组成,D的相对分子质量比物质C小2,即为109,所以D是CH3CH2Br;E由C、H、O三种元素组成,E和C反应生成相对分子质量为100的酯,说明E含有羧基,结合E的球棍模型可知E为CH2=CHCOOH,据此解答.
解答 解:A使溴的四氯化碳溶液褪色,含有不饱和键,结合其比例模型可知,A为CH2=CH2,A能与水在一定条件下反应生成C,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,故C为CH3CH2OH,根据B的组成元素及其球棍模型知,B是苯,结构简式为 ;D由C、H、Br三种元素组成,相对分子质量为109,所以D是CH3CH2Br;E由C、H、O三种元素组成,E和C反应生成相对分子质量为100的酯,说明E含有羧基,结合E的球棍模型可知E为CH2=CHCOOH,
;D由C、H、Br三种元素组成,相对分子质量为109,所以D是CH3CH2Br;E由C、H、O三种元素组成,E和C反应生成相对分子质量为100的酯,说明E含有羧基,结合E的球棍模型可知E为CH2=CHCOOH,
(1)根据上面的分析可知,C是乙醇,A为CH2=CH2,A生成高分子化合物的化学方程式为 nCH2=CH2 $\stackrel{催化剂}{→}$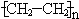 ,
,
故答案为:乙醇; nCH2=CH2 $\stackrel{催化剂}{→}$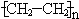 ;
;
(2)A与氢气发生加成反应后生成分子F为CH3CH3,与F互为同系物的通式为CnH2n+2,当n=4时,这类有机物开始出现同分异构体,
故答案为:CnH2n+2;4;
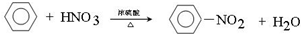
(3)B是 ,B具有的性质是无色有刺激性气味液体、有毒、不溶于水、密度比水小,能与氢气发生加成反应、不能使酸性高锰酸钾溶液和溴水均褪色,故选②③,在浓硫酸作用下,B与浓硝酸反应的化学方程式为
,B具有的性质是无色有刺激性气味液体、有毒、不溶于水、密度比水小,能与氢气发生加成反应、不能使酸性高锰酸钾溶液和溴水均褪色,故选②③,在浓硫酸作用下,B与浓硝酸反应的化学方程式为 ,
,
故答案为:②③; ;
;
(4)C为CH3CH2OH,由C氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(5)C与E反应的反应类型为取代(酯化)反应,反应方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O,
故答案为:取代(酯化)反应;CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
点评 本题考查有机物的结构与性质,难度不大,注意根据有机物的模型与性质进行推断,侧重对基础知识的巩固.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为推广氢能的使用,工业上可采用电解水法制取大量氢气 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 将某些废旧塑料熔化后再成型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | CaO | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com