
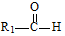 +
+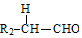 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$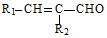 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)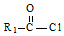 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$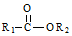 +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基) .
. .
.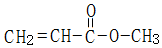
 .
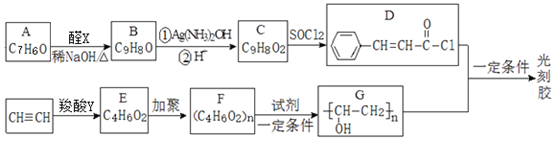
. 分析 由信息可知X含有2个C原子,为CH3CHO,由D的结构可知,A中含有苯环,A与CH3CHO反应得到B,由物质的分子式及信息Ⅰ,可推知A为 ,B为
,B为 ,B与银氨溶液发生氧化反应、酸化得到C,则C为
,B与银氨溶液发生氧化反应、酸化得到C,则C为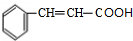 .乙炔和羧酸Y加成生成E,E发生加聚反应得到F,则E分子中含有C=C双键,结合分子式可知,Y为CH3COOH,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,故E为CH3COOCH=CH2,F为
.乙炔和羧酸Y加成生成E,E发生加聚反应得到F,则E分子中含有C=C双键,结合分子式可知,Y为CH3COOH,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,故E为CH3COOCH=CH2,F为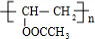 ,G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为:
,G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为: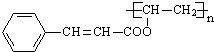 ,以此解答该题.
,以此解答该题.
解答 解:(1)A为 ,分子中含氧官能团名称为醛基,故答案为:醛基;
,分子中含氧官能团名称为醛基,故答案为:醛基;
(2)由以上分析可知B为 ,故答案为:
,故答案为: ;
;
(3)C为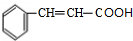 ,发生取代反应生成D,故答案为:取代反应;
,发生取代反应生成D,故答案为:取代反应;
(4)X为乙醛,含有醛基,发生银镜反应的化学方程式是CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3↑+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3↑+H2O;
(5)C为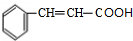 .对应的同分异构体①能与FeCl3溶液发生显色反应,说明含有酚羟基,②能与新制Cu(OH)2反应产生砖红色沉淀,说明含有醛基,③苯环上核磁共振氢谱出现2组峰,则结构对称,对应的结构简式为
.对应的同分异构体①能与FeCl3溶液发生显色反应,说明含有酚羟基,②能与新制Cu(OH)2反应产生砖红色沉淀,说明含有醛基,③苯环上核磁共振氢谱出现2组峰,则结构对称,对应的结构简式为 ,
,
故答案为: ;
;
(6)a.Y为CH3COOH,羧酸Y的分子式是:C2H4O2,故a正确;
b.E为CH3COOCH=CH2,E的核磁共振氢谱峰面积比是:3:1:2,故b正确;
c.F为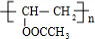 ,F→G发生了水解反应,故c正确;
,F→G发生了水解反应,故c正确;
d.F为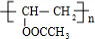 ,F单体的结构简式是CH2=CHOH、CH3COOH,故d错误.
,F单体的结构简式是CH2=CHOH、CH3COOH,故d错误.
故答案为:d;
(7)G与D发生信息Ⅱ的反应得到光刻胶,则光刻胶的结构简式为: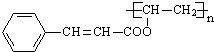 ,该反应方程式为:
,该反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,为高频考点,充分利用转化关系中物质的结构及分子式,结合正、逆推法进行推断,较好的考查学生的分析、推理能力,注意掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
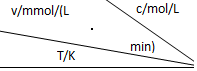 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 不同温度时,蔗糖浓度减少一半所需的时间相同 | |
| C. | b<318.2 | |
| D. | 同时改变反应温度和蔗糖的浓度,v可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
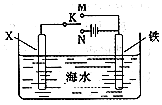 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

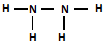
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数相同的元素都在同一族 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 同族元素的最外层电子数一定相同 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油中 | |
| B. | 用棕色试剂瓶盛放新制的氯水 | |
| C. | 冷的浓硝酸不能用钢瓶保存 | |
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (2m-1.6)g | B. | (m-0.8)g | C. | (m-1.6)g | D. | (2m-0.8)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com