
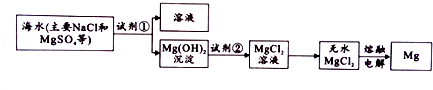
分析 根据题中工业流程图可知,海水中加入碱,使镁离子沉淀,得到氢氧化镁,氢氧化镁溶于盐酸得氯化镁溶液,氯化镁溶液在酸性条件下蒸发得无水氯化镁,电解熔融的氯化镁可得镁,
(1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂,根据元素守恒书写离子方程式;
(2)分离固体和液体用过滤,利用溶解性的差异来分析;
(3)根据氢氧化镁沉淀表面是否有氯离子或硫酸根离子可判断沉淀是否洗净;
(4)镁与铜连接导线,插入稀硫酸中形成原电池,镁是还原剂,与硫酸反应产生氢气,充当原电池的负极;
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,
故答案为:碱;Mg2++2OH-=Mg(OH)2↓;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,
故答案为:过滤;
(3)判断沉是否洗净的方法(或操作)是取最后一次洗涤液少许于试管,滴加足量稀硝酸,再加少量硝酸银溶液,若无白色沉淀生成,则已洗净,(或取最后一次洗涤液少许于试管,滴加足量稀盐酸,再加少量氯化钡溶液,若无白色沉淀生成,则已洗净),
故答案为:取最后一次洗涤液少许于试管,滴加足量稀硝酸,再加少量硝酸银溶液,若无白色沉淀生成,则已洗净,(或取最后一次洗涤液少许于试管,滴加足量稀盐酸,再加少量氯化钡溶液,若无白色沉淀生成,则已洗净);
(4)镁与铜连接导线,插入稀硫酸中形成原电池,镁是还原剂,与硫酸反应产生氢气,充当原电池的负极,电极反应式为,
故答案为:Mg-2e-=Mg 2+.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸配制稀硫酸时,浓硫酸缓慢加入水中,并用玻璃棒不断搅拌 | |
| B. | 用酒精和汽油都可以萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干再停止加热 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH5属于离子晶体 | |
| B. | NH5中存在共价键 | |
| C. | NH5与水反应是非氧化还原反应 | |
| D. | NH5与NH3溶于水后所得溶液均为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL,117g | B. | 950mL,111.2 g | C. | 任意规格,117g | D. | 500mL,111.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 9.6g | C. | 19.2g | D. | 24g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com