
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯P(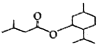 )是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:

已知:
RCH=CH2 ![]() RCH2CHBr(R表示烃基)
RCH2CHBr(R表示烃基)
完成下列问题:
(1)A的化学名称为__________。
(2)试剂l的结构简式为__________。
(3)由E生成F的化学方程式为__________;该反应类型是__________。
(4)试剂2可以是__________试剂(填名称或化学式)
(5)由C和H生成P的化学方程式为__________。
(6)H的同分异构体中,能发生水解反应的链状化合物共有_________种(不考虑立体异构);其中核磁共振氢谱有两种峰、且峰值比为9:1的同分异构体的结构简式为__________。
(7)苯乙烯是一种重要的化工原料,参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:
合成路线常用的表示方法为:![]()
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法中不正确的是 ( )
A. 化学键是一种作用力
B. 化学键可以使原子相结合,也可以使离子相结合
C. 化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D. 非极性键不是化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
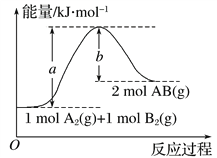
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有标准状况下V L 气体AB3,它的摩尔质量为M g·mol-1。则:
(1)该气体所含原子总数为________________个(列出计算式即可,下同)。
(2)该气体的质量为_____________g。
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________。
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为_______________ mol·L-1。
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度为_____________________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备 ClO2 的流程如下:
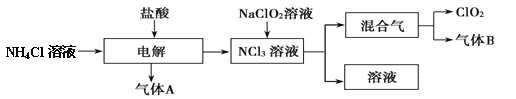
(1)ClO2 中所有原子_____(填“是”或“不是”)都满足 8 电子结构。上图所示方法制得的混合气中杂质气体 B 能使石蕊试液显蓝色,除去该杂质气体可选用_____;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是_____;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离, 还可能污染环境。写出该方法发生的化学方程式_____;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是______,此法相比欧洲方法的优点是_____。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____,此法提高了生产及储存、运输的安全性,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列填空。
(1)已知氢气的化学式是H2,其摩尔质量为______;4 g H2的物质的量为__mol,其标准状况下的体积为_____L,其含H2分子的个数为________,含有氢原子的个数为__________;
(2)某学生欲用12 mol·L-1浓盐酸和蒸馏水配制500 mL物质的量浓度为0.60 mol/L的稀盐酸。该学生需要量取___________ mL上述浓盐酸进行配制。
(3)现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。回答下列问题:该混合气体的平均摩尔质量为_____________,该混合气体中含CO2的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硬脂酸甘油酯是天然高分子化合物
B.葡萄糖在酒化酶催化下,可以水解为乙醇,这是酿酒的原理
C.浓的硫酸钠溶液加入鸡蛋清中,蛋白质变性而凝聚
D.“离离原上草,一岁一枯荣”,小草富含纤维素,可以用来造纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com