
(6 分)课本“交流?研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol 氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ 能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。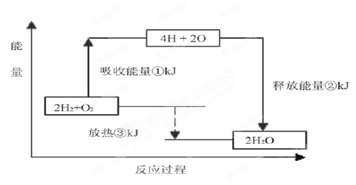
① _______________ kJ ②________________ kJ ③_________________kJ
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:2014届江西上饶中学高一零点、实验班下期末化学试卷(解析版) 题型:填空题
(6 分)课本“交流•研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol 氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ 能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。

① _______________ kJ ②________________ kJ ③_________________kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com